Chapitre 1
- théorie de
l'électricité
L'électricité est une forme d'énergie qui peut produire de la chaleur, de la lumière, des mouvements par attraction et répulsion, ainsi que beaucoup d'autres effets physiques et chimiques.
Elle tire son nom du mot grec êlektron, lequel donna naissance à électron, qui est la particule élémentaire possédant la plus petite charge d'électricité.
Nous reviendrons sur ce terme «charge» plus tard mais, puisqu'il est question de particule et donc, de manière classique, de matière, nous traiterons de cette dernière en premier lieu avant d'aborder l'objet principal de cet ouvrage:
Ce chapitre portera sur la matière selon ses deux modèles moléculaire et atomique.
Nous y traiterons des principales grandeurs électriques dont nous nous servirons tout au long de ce texte. Ses principaux sujets sont:
1.1 Matière et énergie
1.2 Structure moléculaire
1.3 Structure atomique
1.4 Charge électrique, électrons de valence, électrons libres et ions
1.5 Charge statique et électricité statique, décharge statique, applications de l'électricité statique
1.6 Unité de charge, courant et porteurs de courant, courant dans les solides, unité d'intensité de courant: l'ampère
1.7 Tension, énergie, travail, force et leurs unités, unité de tension: le volt
1.8 Résistance, conducteurs, isolants, semi-conducteurs, unité de résistance: l'ohm, coefficient de température, résistivité, composants résistants, conductance
1.9 Polarité, sources d'électricité, circuit fermé, circuit ouvert
1.10 Courant continu (ce) et courant alternatif (ca)
1.11 Puissance et rendement
1.1 MATIÈRE ET ÉNERGIE
Propriétés de la matière La matière est caractérisée par ses propriétés physiques, c'est-à-dire qui n'altèrent pas sa nature et par ses propriétés chimiques qui, elles, modifient sa nature.
Parmi les propriétés physiques citons la masse volumique, la couleur, l'état, le point d'ébullition et le point de fusion.
Citons un exemple d'altération chimique: le carbone en présence d'oxygène brûle en produisant un gaz, le bioxyde de carbone.
Mesure des propriétés
Cette mesure s'effectue par comparaison.
La longueur d'un crayon, par exemple, est déterminée par référence à. une échelle comportant une unité de longueur arbitraire.
On utilisera dans ce texte les unités SI.
Dans ce système d'unité, la masse s'exprime en kilogrammes (kg), le poids d'un objet ou, plus précisément, la force de gravitation s'exerçant sur lui, en newtons (N), la longueur, en mètres (m), le volume, en mètres cubes (m³), etc.
Lois de la conservation La masse totale de la matière transformée ne varie pas, que cette transformation soit physique ou chimique.
Dans le cas d'une transformation chimique, par exemple, la mesure précise de la masse des corps réagissants et de celle des produits d'une réaction chimique ne permet pas de constater de gain ou de perte de matière, même lorsque la transformation en jeu fait apparaître des substances à l'état gazeux.
Cette loi a été révélée par le chimiste français Lavoisier sous le nom de loi de conservation de la masse.
En 1905, Einstein démontra que la matière peut se manifester sous deux formes distinctes:
elle peut exister sous forme de substance matérielle possédant une masse et occupant un espace défini, ou elle peut apparaître sous forme d'énergie. La quantité de masse associée à une quantité d'énergie est donnée par la formule:
E = mc² (1.1)
où E est la quantité d'énergie, m la masse et c la vitesse de la lumière.
Dans les réactions nucléaires, une petite quantité de matière semble être détruite.
En effet une partie de la masse mise en jeu se transformme en énergie, mais la quantité d'énergie ïbérée équivaut à la masse disparue.
Les lois de la conservation que nous venons d'explorer peuvent se fondre en un seul énoncé: le couple masse-énergie d'un système demeure toujours constant.
États de la matière La matière existe sous trois états différents: solide, liquide et gazeux.
Un solide possède une forme propre et a un volume déterminé.
Un liquide possède un volume défini mais il n'a pas de forme propre; il épouse la forme du récipient qui le contient.
Un gaz n'a ni forme propre ni volume déterminé; il cherche à occuper le plus grand volume possible en prenant la forme du récipient qui le renferme.
La température et la pression sont les facteurs qui déterminent l'état physique d'une substance donnée. Sous l'influence des variations de température ou de pression (ou des deux à la fois), une substance peut passer d'un état à un autre. Ces transformations de la matière sont des phénomènes physiques.
La vaporisation est le passage d'une substance de l'état liquide à l'état gazeux.
Elle se produit lorsque la substance absorbe une quantité suffisante de chaleur. On assiste au phénomène contraire, c'est-à-dire au passage de l'état gazeux à l'état liquide quand une substance rejette de la chaleur: c'est la condensation (ou liquéfaction).
La fusion est le passage d'une substance de l'état solide à l'état liquide sous l'influence d'une absorption de chaleur. Lorsqu'on retire suffisamment de chaleur à une substance liquide, elle passe à l'état solide: c'est le phénomène de la solidification.
Enfin, certaines substances, telles que la glace sèche (bioxyde de carbone à l'état solide), peuvent passer directement de l'état solide à l'état gazeux: c'est ce que l'on appelle la sublimation.
Le phénomène contraire peut aussi se produire. La formation du frimas est un autre exemple de sublimation sans passage apparent par l'état liquide.
Problèmes pratiques 1.1 (réponses à la fin du chapitre)
a) Quelle est l'origine du mot «électricité»?
b) Quelle est la différence fondamentale entre les propriétés physiques et les propriétés chimiques de la matière? l
c) Citer les trois états de la matière.
1.2 STRUCTURE MOLÉCULAIRE
Essayons de nous représenter mentalement l'expérience suivante.
D'un récipient contenant une certaine quantité d'eau, nous transférons la moitié de cette eau dans un second récipient Ainsi chaque moitié conserve la composition chimique et les propriétés de l'ensemble original.
Or, en subdivisant plusieurs fois l'un des échantillons, nous arriverons à un point où la particule d'eau obtenue sera si petite que nous serons dans l'impossibilité de la dédoubler davantage par des moyens physiques. Cette plus petite particule qui puisse exister à l'état libre sans cesser d'être de l'eau s'appelle une molécule.
Les molécules sont extrêmement petites et l'on ne peut les observer directement, même à Paide des plus puissants microscopes. Leur existence ne peut être démontrée que par des méthodes indirectes, mais les progrès constants de la chimie permettent d'acquérir des connaissances de plus en plus précises sur la structure moléculaire.
Éléments
Les matériaux dont l'univers est fait se composent d'un nombre relativement restreint de corps simples appelés éléments, lesquels, par définition, ne peuvent être décomposés en substances plus simples par des moyens chimiques. On en a relevé, à ce jour, 118.
Les atomes sont les plus petites particules de matière qui puissent entrer en combinaison chimique; on peut les qualifier d'unités chimiques fondamentales de la matière.
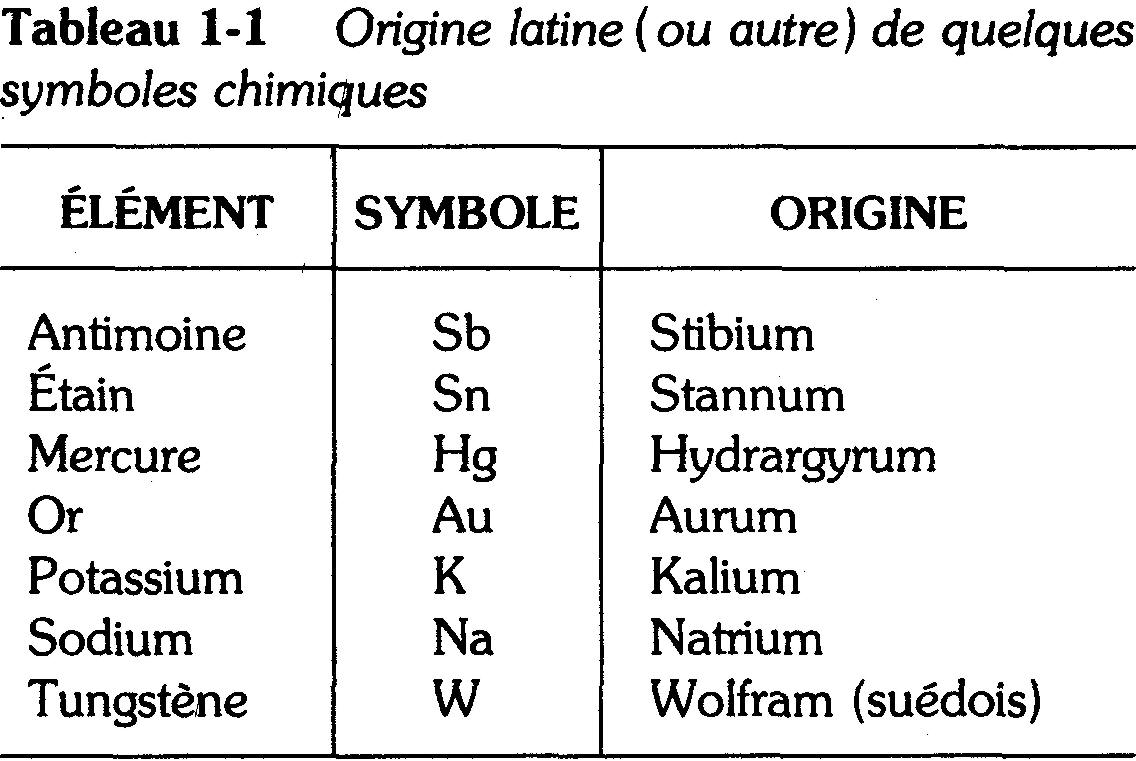
Pour simplifier l'écriture chimique, on se sert d'un système de symboles chimiques représentant les éléments, leurs atomes et les masses atomiques de ces derniers. On utilise comme symboles les initiales des noms des éléments.
Par exemple, H est le symbole de l'hydrogène, O celui de l'oxygène et S celui du soufre. Lorsque les noms de plusieurs éléments commencent par la même lettre, on en ajoute une seconde.
Ainsi, puisque C représente le carbone, on aura Ca pour le calcium, Cd pour le cadmium, Ce pour le cérium, Cs pour le césium, Co pour le cobalt et Cr pour le chrome.
La seconde lettre est toujours une minuscule.

Les éléments se combinent les uns aux autres pour former des composés. Ces derniers sont des substances homogènes ayant une composition uniforme et des propriétés identiques en toutes leurs parties.
On ne peut distinguer, dans un composé, les particules des éléments constituants. Les propriétés d'un composé sont tout à fait différentes de celles des éléments qui sont entrés en combinaison.
Donnons un exemple illustrant ce fait.
L'eau est un corps constitué par l'union de l'hydrogène et de l'oxygène. Ces deux éléments sont des gaz à l'état naturel. Or l'hydrogène est très inflammable et l'oxygène entretient la combustion.
Pourtant, l'eau a des propriétés fort différentes de celles de ses constituants.
L'atome d'un élément est représenté par un symbole, tandis que la molécule d'un élément ou d'un composé est représentée par une formule.
La formule d'une molécule réunit les symboles des éléments qui constituent le composé. Les nombres d'atomes des éléments présents dans le composé sont indiqués au moyen d'indices placés à droite en bas des symboles. L'indice 1 est toujours sous-entendu.
Ainsi, la formule de l'eau, H2O, indique que la molécule contient deux atomes d'hydrogène et un atome d'oxygène.
La molécule d'oxygène contient deux atomes; sa formule est donc O2.
Pour certaines formules, on fait usage de parenthèses; par exemple, la formule du nitrate de cuivre est Cu(NO3)2.
Dans ce cas, l'indice venant après la parenthèse indique le nombre de fois que le groupe d'atomes à l'intérieur des parenthèses apparaît dans la formule.
Un mélange est une simple juxtaposition de substances conservant chacune leurs propriétés. Du sucre dissous dans l'eau donne un mélange homogène où les constituants ne peuvent être distingués au microscope; on a donc là une solution.
Certains mélanges diffèrent des solutions en ce qu'ils comportent des parties différentes, appelées phases, et séparées les unes des autres par des délimitations physiques; ce sont des mélanges hétérogènes, dont un échantillon de granit constitue un bon exemple.
Un examen rudimentaire révèle la présence de trois substances cristallines dans le granit: le quartz, le feldspath et le mica.
Les mélanges peuvent donc être homogènes ou hétérogènes; tous, cependant, renferment au moins deux substances.
Dans le cas des mélanges hétérogènes, les substances constituantes peuvent être présentes dans des proportions variant à l'infini.
Dans certaines solutions, le degré de solubilité varie avec chaque substance.
Ainsi, à une température de 20°C, 100 g d'eau ne peuvent dissoudre plus de 36 g de chlorure de sodium. En deçà de cette limite, on peut varier à volonté la concentration en chlorure de sodium.
La composition d'un mélange est donc variable, tandis que celle d'un composé ne l'est pas.
Les constituants d'un mélange conservent leurs propriétés, desquelles se déduisent celles du mélange. L'air, la terre, le papier, la peinture et le charbon sont quelques exemples de mélanges communs.
L'une des tâches importantes du chimiste consiste à déterminer la composition de corps composés. Pour effectuer cette recherche, il a recours à deux méthodes générales de travail: l'analyse et la synthèse.
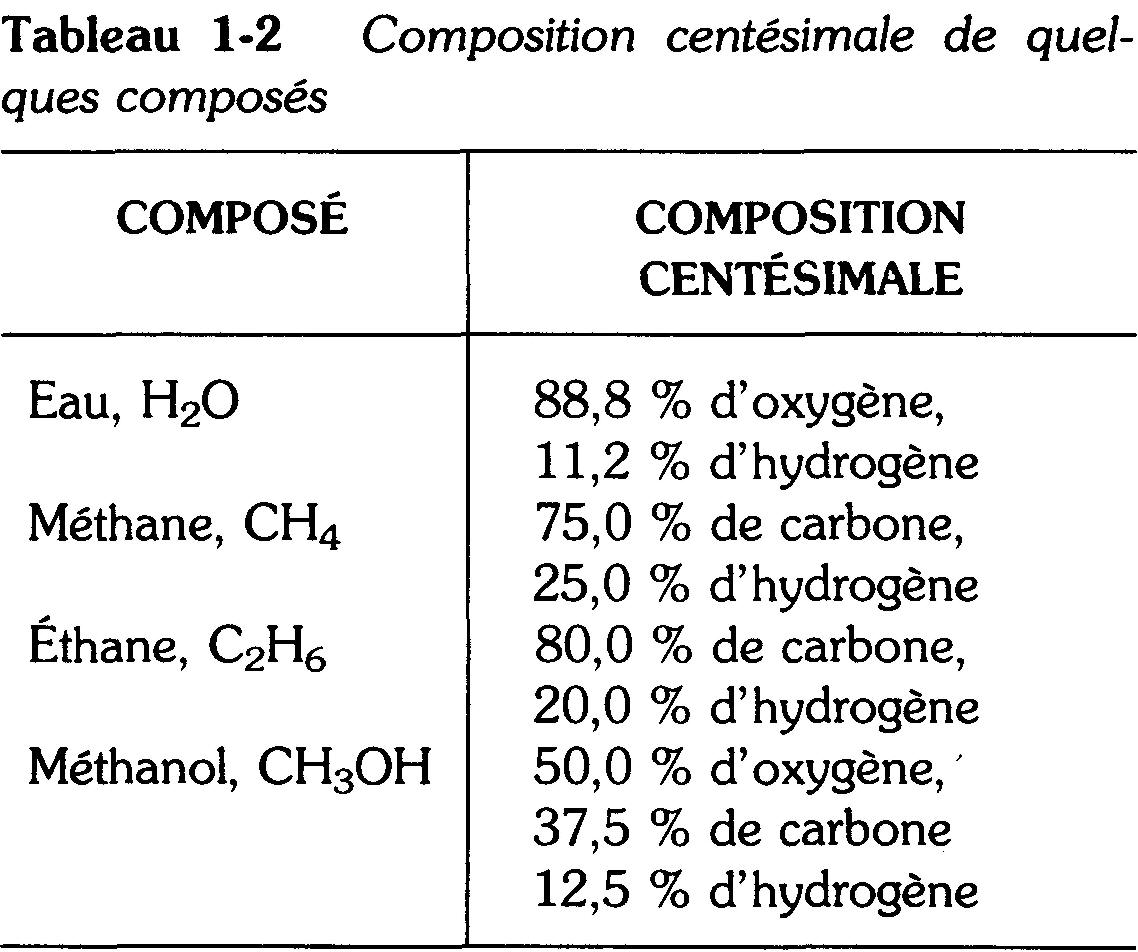
La composition d'environ un million de corps a été trouvée au moyen de ces méthodes. Dans chaque cas, les recherches ont révélé que le pourcentage en masse de chaque élément constituant était constant.
Ces résultats sont formulés dans la loi des proportions définies qui stipule que, dans un composé chimique pur, les mêmes éléments sont toujours unis dans les mêmes proportions en masse.
Le tableau 1-2 donne quelques exemples de compositions centésimales.
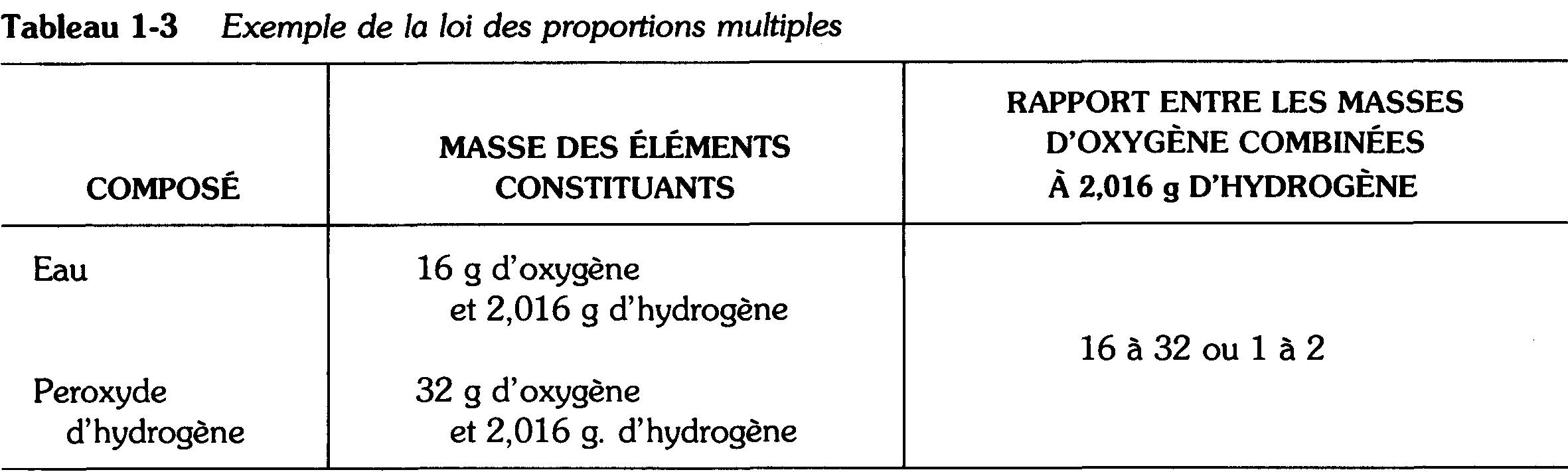
II arrive que les mêmes éléments se combinent dans des rapports différents pour donner divers composés. Par exemple, le monoxyde de carbone et le bioxyde de carbone contiennent respectivement 16 g et 32 g d'oxygène combinés à 12 g de carbone.
Dans ces composés, les différentes masses d'oxygène qui se sont combinées à la même masse de carbone sont dans un rapport de 16 à 32 ou de 1 à 2.
Dans tous les cas semblables, il existe un rapport simple entre les diverses masses d'un élément qui se combinent à une même masse d'un autre élément.
C'est la loi des proportions multiples que l'on peut exprimer de la façon suivante: lorsque deux éléments A et B se combinent pour former plusieurs composés, les différentes masses de A qui entrent en combinaison avec une masse donnée de B sont entre elles dans des rapports simples.
L'eau et le peroxyde d'hydrogène constituent une autre application de cette loi. La relation entre les masses d'oxygène et d'hydrogène que l'on retrouve dans ces composés est indiquée au tableau 1-3.
Problèmes pratiques 1.2 (réponses à la fin du chapitre)
Répondre par vrai ou faux:
(a) Les éléments sont décomposables en substances plus simples;
(b) Les atomes sont les plus petites particules qui puissent entrer en combinaison chimique;
(c) La composition centésimale de l'eau est de 88,8 % d'oxygène et de 11,2 % d'hydrogène.
1.3 STRUCTURE ATOMIQUE
Toute matière ou substance, de même que tous les objets sont composés d'atomes. Les atomes sont les blocs de construction universels de la nature.
Indépendamment de leurs caractéristiques physiques, le verre, la craie, le roc et le bois sont tous constitués d'atomes.
Le roc est différent du bois par son type d'atomes distinct de celui du bois.
Il existe plus de 100 types d'atomes différents. Chaque type d'atomes est appelé un élément. Il existe donc plus de 100 éléments différents. Le cuivre, l'argent et l'or sont des éléments.
Nous venons de voir que toute matière est constituée d'atomes.
Mais, pour réellement comprendre l'électricité, nous devons «scinder» l'atome en particules plus petites.
Pour bien comprendre l'électricité, les trois particules principales de l'atome, soit l'électron, le proton et le neutron, doivent nous devenir familières.
La figure 1-1 représente de façon imagée les trois particules principales d'un atome d'hélium.
Figure 1-1 Structure d'un atome d'hélium.
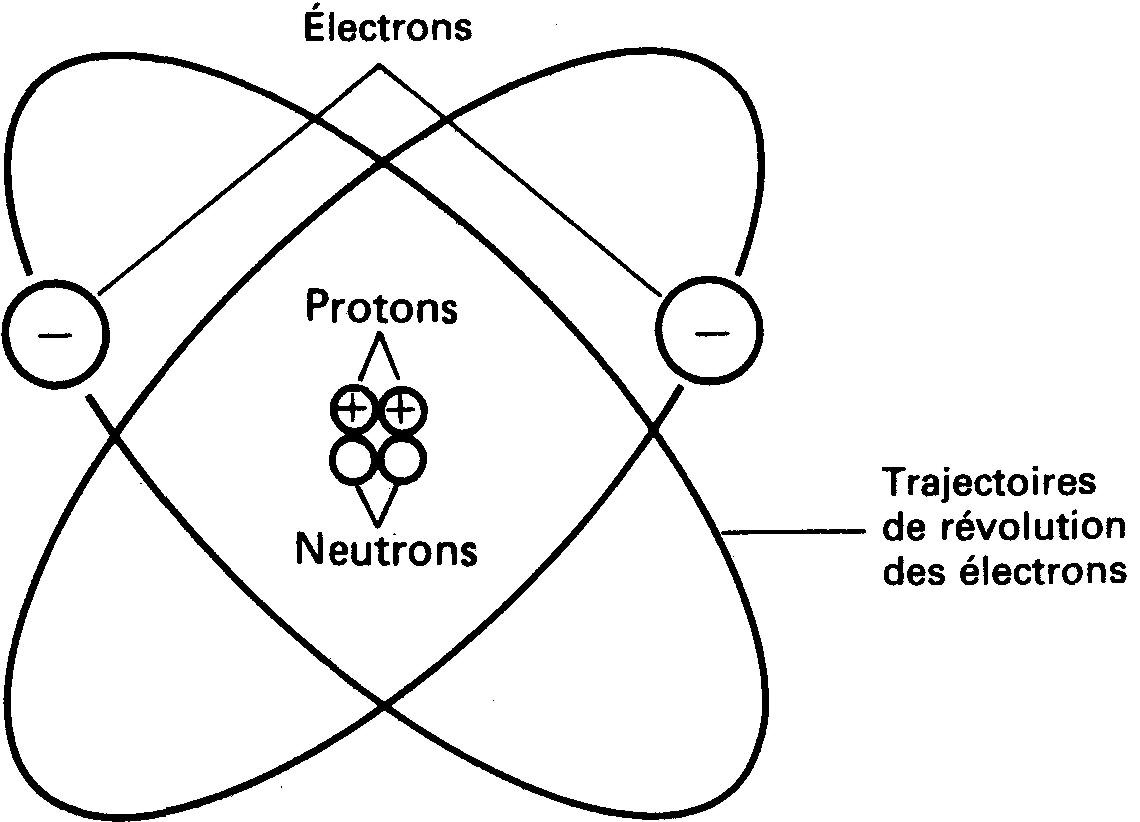
Le centre de l'atome est appelé son noyau.
Ce noyau contient les protons et les neutrons. Les électrons tournent autour du noyau selon des trajectoires elliptiques.
L'électron est beaucoup plus volumineux (près de 2000 fois plus volumineux) que le proton et le neutron. Malgré cela, l'électron est beaucoup plus léger (près de 2000 fois plus léger) que le proton et le neutron.
Le noyau contient donc la plus grande partie de la masse d'un atome, mais les électrons se réservent la plus grande partie du volume occupé par la masse d'un atome.
Remarquons aussi que la distance entre le noyau et un électron est énorme par rapport à la dimension de cet électron. En fait, cette distance est d'environ 60 000 fois le diamètre de l'électron.
L'analogie suivante permet de mieux entrevoir les dimensions relatives des particules atomiques et des distances entre elles.
Supposons le noyau de l'atome d'hydrogène représenté par une dalle de pavement en marbre ordinaire.
L'électron serait alors représenté par une sphère de 31 m de diamètre située à 1610 km de cette dalle. Cette distance entre le noyau et l'électron est relativement grande par rapport à leurs dimensions respectives, mais nous devons nous souvenir que ces dimensions et distances sont sous-microscopiques.
En réalité le diamètre d'un électron n'est que de 4 x 10-13 cm (0,000 000 000 000 4 cm).
Les électrons décrivent des orbites autour du noyau de l'atome de la même manière, en quelque sorte, que la terre tourne autour du soleil (figure 1-1).
Les atomes plus complexes comprennent plusieurs électrons, mais chaque électron possède sa propre orbite. La coordination des électrons en orbite permet le partage d'un même espace entre plusieurs atomes.
Mieux encore, dans de nombreuses substances les atomes voisins se partagent non seulement un même espace, mais aussi des électrons.
La figure 1-2 représente, en deux dimensions, un atome d'aluminium.
Figure 1-2 Représentation simplifiée d'un atome d'aluminium montrant ses 13 électrons ( — ), ses 13 protons ( + ) et ses 14 neutrons (N).
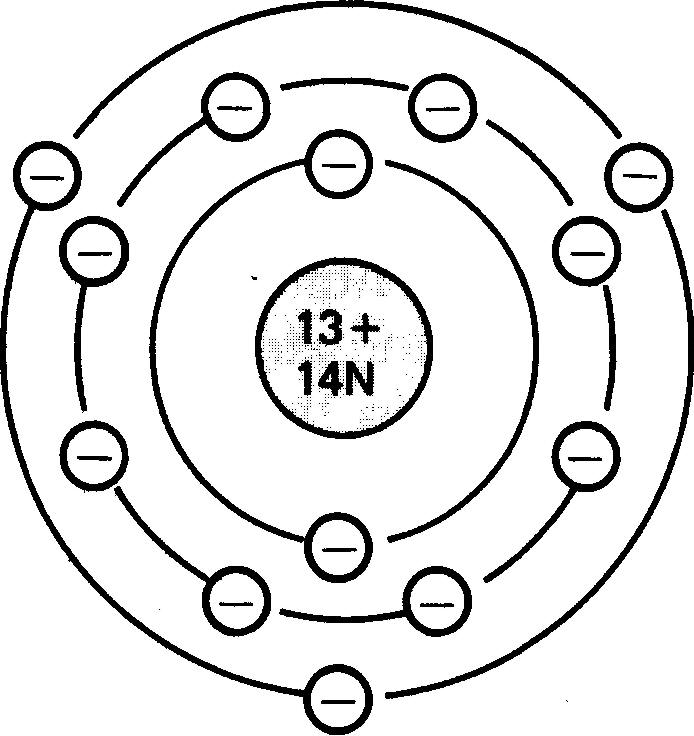
Rappelons-nous que chaque électron décrit sa propre orbite autour du noyau. Les deux électrons les plus proches du noyau ne décrivent pas en réalité la même orbite. Leur distance moyenne à partir du noyau est la même.
On dit que les deux électrons les plus proches du noyau occupent la première couche orbitale (en abrégé couche) ou encore le premier niveau d'énergie de l'atome.
Cette première couche ne peut contenir que deux électrons. Les atomes à plus de deux électrons comme celui de l'aluminium, par exemple, présentent au moins une deuxième couche.
La deuxième couche d'un atome d'aluminium contient huit électrons. C'est le nombre maximal d'électrons que la seconde couche de n'importe quel atome peut contenir.
La troisième couche contient au maximum 18 électrons et la quatrième au maximum 32 électrons, peu importe la substance envisagée.
Comme l'atome d'aluminium (figure 1-2) n'a que 13 électrons, sa troisième couche ne comporte que trois électrons. Le nombre d'électrons ou de protons d'un atome à l'état naturel d'un élément donné est appelé le numéro atomique de cet élément.
Problèmes pratiques 1.3 (réponses à la fin du chapitre)
(a) Quelles sont les principales particules d'un atome?
(b) Quelle partie de l'atome contient la plus grande part de sa masse?
(c) Quelle particule de l'atome contient la plus grande part du volume occupé par sa masse?
(d) Comparer le diamètre d'un électron et la distance d'un électron à un proton. Lequel a la plus grande valeur?
1.4 CHARGE ÉLECTRIQUE, ÉLECTRONS DE VALENCE, ÉLECTRONS LIBRES ET IONS
Charge électrique Les électrons et les protons possèdent des charges électriques mais ces charges sont de polarités opposées.
La polarité indique le type de charge (négative ou positive).
L'électron possède une charge négative ( —), tandis que le proton possède une charge positive ( + ). Ces charges électriques créent des champs de force électriques qui se comportent comme des champs de force magnétiques.
Reportons-nous à la figure 1-3, le noyau de l'atome, ne possède aucune charge électrique. On peut donc, si l'on considère la charge électrique de l'atome, ignorer les neutrons.
Figure 1-3 Champs électriques entre les charges: (a) et (b), des charges semblables se repoussent; (c), des charges opposées s'attirent.
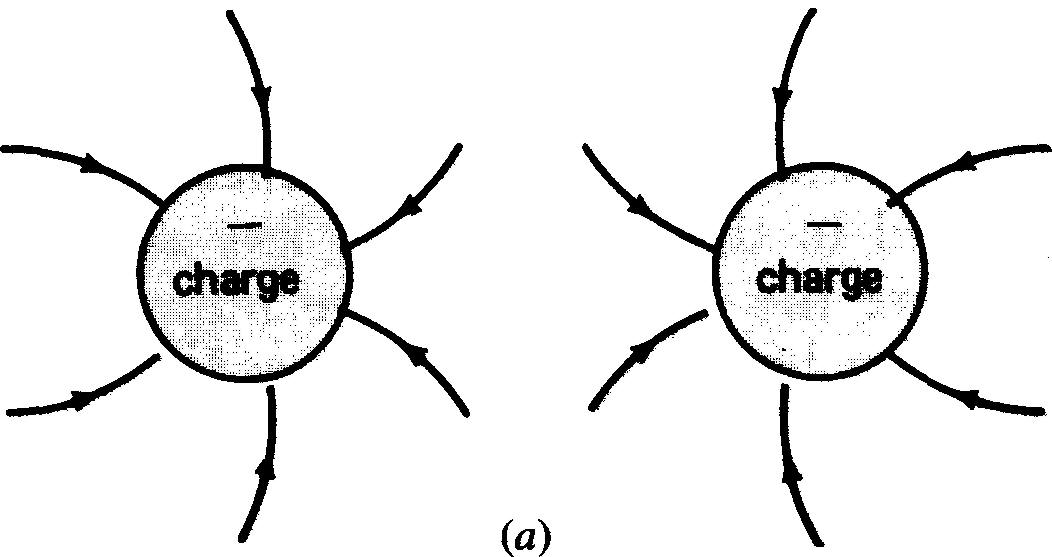
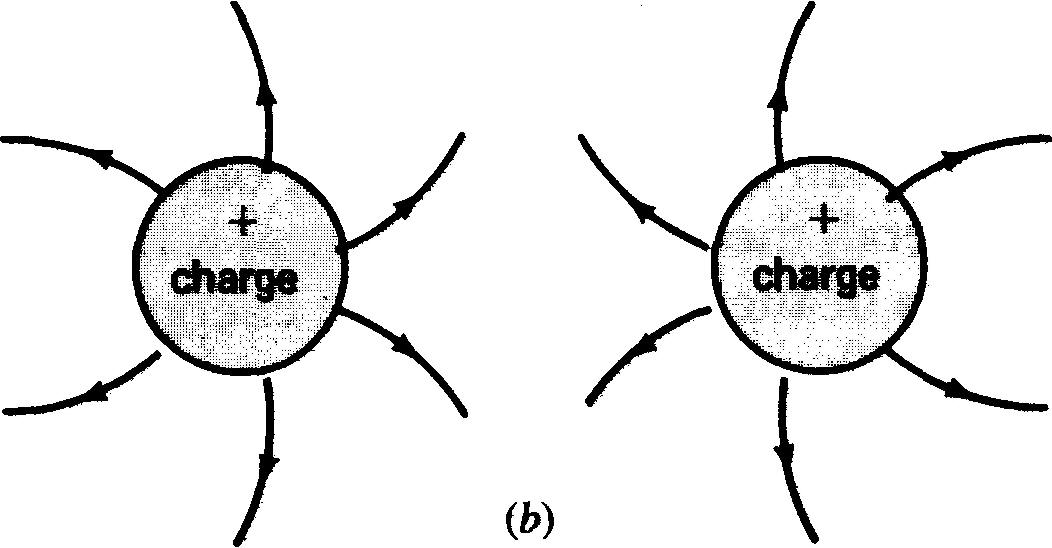
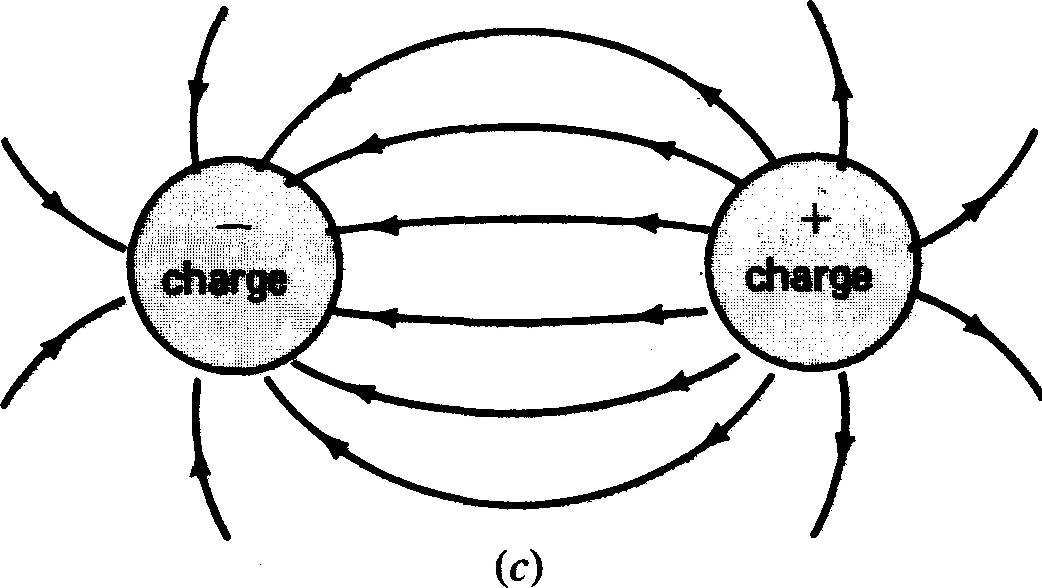
Selon les lois de Newton régissant le mouvement des corps, il existe une force résultante dite centripète tendant à faire «tomber» les électrons sur le noyau. Cette force est contrebalancée par une force dite centrifuge qui, elle, tend à expulser les électrons hors de leur trajectoire.
Dans son état naturel ou neutre, un atome présente toujours une charge électrique nette nulle, ce qui signifie qu'il possède autant d'électrons que de protons.
Considérons, par exemple, l'atome d'aluminium illustré (sous forme simplifiée) à la figure 1-2.
Ses 13 électrons décrivent des orbites autour de son noyau, ce noyau contient 13 protons en plus de ses 14 neutrons. Nous pouvons donc dire que l'atome d'aluminium est électriquement neutre, bien que les électrons et les protons pris individuellement soient électriquement chargés.
Électrons de valence Les électrons de la couche extérieure d'un atome sont appelés les électrons de valence. Les électrons de valence sont les particules atomiques impliquées dans les réactions chimiques et les courants électriques.
La force d'attraction entre des charges opposées est une des forces de maintien en orbite des électrons. Plus les charges électriques sont rapprochées, plus leur attraction électrique est grande. L'attraction entre un proton du noyau et un électron diminue donc à mesure que cet électron s'éloigne du noyau.
Les électrons de valence sont donc soumis par le noyau à une force d'attraction moins grande que les électrons des couches internes. Ils peuvent ainsi être arrachés plus facilement de leur atome que ceux des autres couches.
*Certains métaux ont plusieurs valences quand ils forment des composés chimiques. Voici quelques exemples: le cuivre cuivreux ou cuivrique, le fer ferreux ou ferrique, l'or aureux ou aurique.
Tous les électrons possèdent de l'énergie. Ils possèdent de l'énergie car ils ont une certaine masse et qu'ils se déplacent. Ils sont donc capables d'accomplir un certain travail. Les électrons de valence possèdent plus d'énergie que ceux des autres couches.
En général, plus un électron est loin du noyau, plus il possède de l'énergie. Lorsqu'un électron est arraché de son atome, son niveau d'énergie croît. Devenu électron libre, il possède plus d'énergie qu'il en avait à l'état d'électron de valence.
Électrons libres
Les électrons libres sont des électrons de valence arrachés momentanément de leur atome. Ils se promènent librement dans l'espace libre autour de l'atome. Ils ne sont attachés à aucun atome particulier.
Seuls les électrons de valence peuvent devenir des électrons libres. Les électrons des couches internes sont très fortement liés à leur atome.
Ils ne peuvent en être arrachés. Comme les électrons libres possèdent davantage d'énergie que les électrons de valence, ils peuvent être créés en fournissant de l'énergie supplémentaire à la structure atomique. Cette énergie supplémentaire permet à un électron de valence d'échapper à la force d'attraction entre lui et le noyau.
Une façon de fournir l'énergie supplémentaire nécessaire à la libération d'un électron est de chauffer l'atome. Une autre façon est de soumettre l'atome à un champ électrique.
Ions Lorsqu'un électron de valence quitte son atome pour devenir un électron libre, il emporte avec lui une charge électrique négative. Cette absence d'une charge électrique négative dans cet atome laisse ce dernier avec une charge nette positive. Dans le cas de l'atome d'aluminium, cela donne 13 protons (charges positives), mais seulement 12 électrons (charges négatives).
Les atomes qui comportent plus, ou moins, d'électrons que leur nombre normal sont appelés des ions. Lorsqu'un atome perd des électrons, il devient un ion positif.
Réciproquement, des atomes comportant un excès d'électrons possèdent une charge nette négative et deviennent des ions négatifs. La quantité d'énergie requise pour libérer un électron de valence et donc créer un ion varie d'un élément à l'autre.
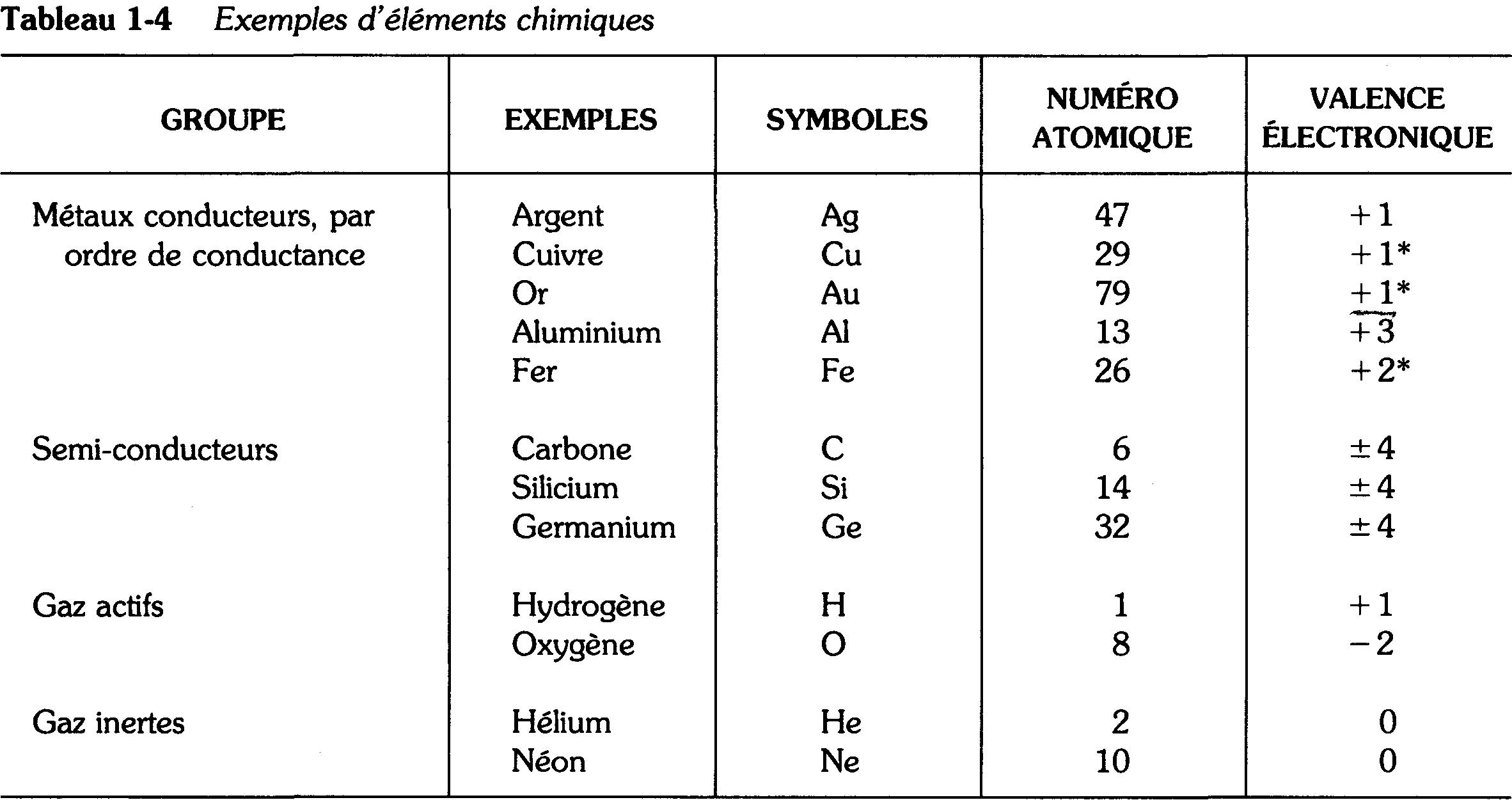
L'énergie requise pour créer un électron libre dépend du nombre d'électrons de valence contenus dans l'atome. En général, moins la couche de valence contient d'électrons et moins il faut d'énergie supplémentaire pour libérer un électron. L'atome d'argent illustré à la figure 1-4 requiert relativement peu d'énergie pour libérer son unique électron de valence.
Figure 1-4 Atome d'argent simplifié.
Par contre, le carbone à quatre électrons de valence requiert beaucoup plus d'énergie pour libérer un de ses électrons. Les éléments à cinq électrons ou plus dans la couche externe ne libèrent pas facilement leurs électrons de valence.
La création d'un ion négatif survient lorsqu'un atome à cinq électrons ou plus dans sa couche externe, accepte des électrons supplémentaires.
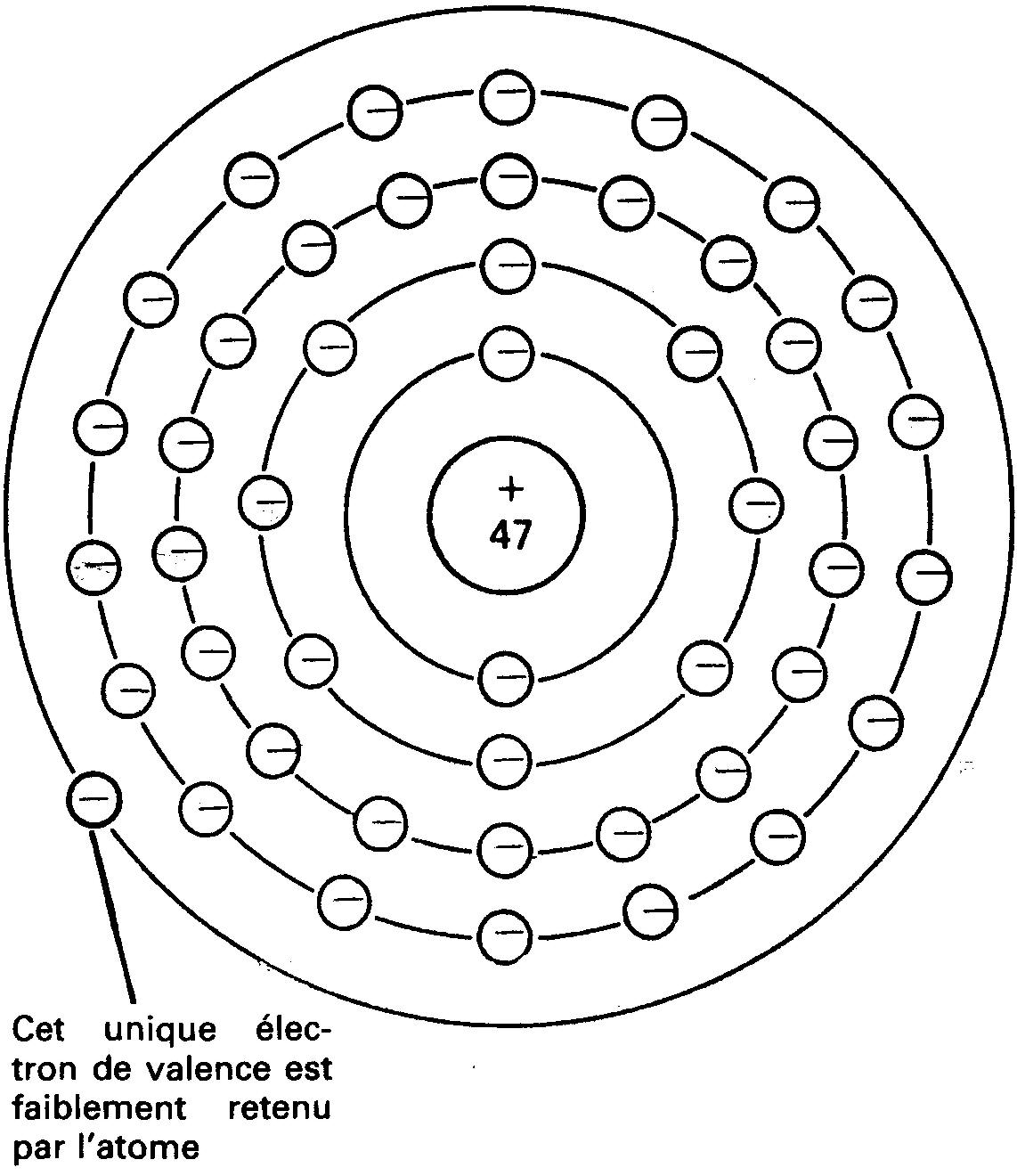
Si, par exemple, on ajoute du sel de table (chlorure de sodium) à de l'eau, l'atome de chlore reçoit un électron supplémentaire et devient un ion négatif. Au même instant l'atome de sodium qui perd un électron devient un ion positif (figure 1-5).
Figure 1-5 Création de ions (sodium) positifs et de ions (chlore) négatifs.
Ce concept des ions est important pour la compréhension des circuits électriques comprenant des batteries et des composants à gaz.
Problèmes pratiques 1.4 (réponses à la fin du chapitre)
(a) Quelle est la polarité de la charge d'un électron?
(b) Est-ce qu'un atome est électriquement chargé?
(c) Quel nom particulier porte un atome ayant perdu un électron de valence?
(d) Lequel, d'un électron libre ou d'un électron de valence, possède la plus grande énergie?
1.5 CHARGE STATIQUE ET ÉLECTRICITÉ STATIQUE, DÉCHARGE STATIQUE, APPLICATIONS DE L'ÉLECTRICITÉ STATIQUE
Charge statique et électricité statique
L'électricité statique est un phénomène habituel que chacun a déjà constaté. L'éclair en est probablement l'exemple le plus saisissant. Les chocs que l'on reçoit parfois en touchant une poignée de porte métallique après avoir marché sur un tapis épais sont dus à l'électricité statique.
L'adhérence des cheveux à un peigne, des vêtements en tissu synthétique entre eux est également due à l'électricité statique.
Tous les phénomènes décrits ci-dessus ont un point commun. Ils impliquent tous le transfert d'électrons d'un objet à un autre, d'une substance à une autre.
Une charge statique positive apparaît lorsqu'un transfert d'électrons laisse un objet déficitaire en électrons.
Une charge statique négative apparaît lorsqu'un objet comporte un excédent d'électrons. Des charges statiques peuvent être créées en frottant une tige de verre avec un tissu de soie.
Le tissu est vigoureusement frotté sur la tige de verre. Quelques électrons de valence de la tige deviennent libres et sont transférés au tissu. Le tissu possède dès lors une charge négative et la tige, une charge positive. Les charges de la tige et celles du tissu tendent à demeurer stationnaires, d'où le nom d'électricité statique.
L'électrostatique est une branche de la physique, elle traite des phénomènes d'électricité statique et étudie les charges électriques en équilibre.
Un objet qui possède une charge statique peut en attirer d'autres qui ne sont pas chargés.
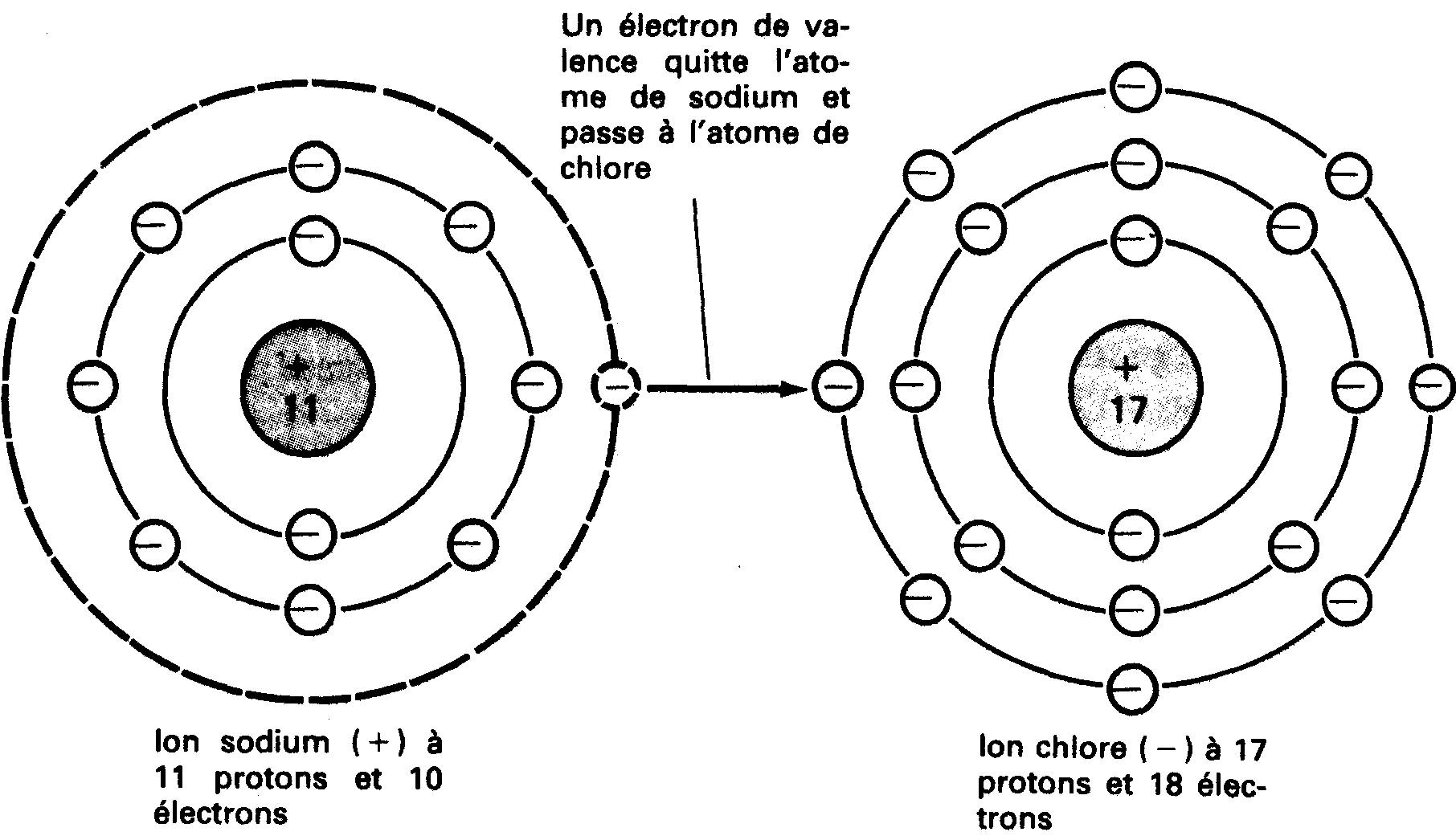
En effet, un objet chargé peut induire une charge à la surface de l'objet non chargé (figure 1-6).
Figure 1-6 Induction d'une charge statique. La mise en contact de la bille avec la tige permet le transfert d'électrons de cette dernière à la tige. La charge de la bille est devenue positive.
La charge induite, de polarité opposée à celle de l'objet chargé, est alors attirée vers l'objet chargé.
Si les deux objets (la bille et la tige de la figure 1-6) sont mis en contact, une partie de la charge positive de la tige sera transmise à la bille. Les deux objets seront alors chargés positivement, il en résultera une force de répulsion. La tige repoussera alors la bille.
Exposons clairement le transfert d'une charge positive de la tige positive à la bille (figure 1-6). Lors de la mise en contact de ces deux objets, des protons ne circulent pas de la tige vers la bille.
Rappelons-nous que l'électron est la seule particule de l'atome qui peut être facilement détachée et circuler aux alentours de l'atome.
Lorsque la tige et la bille sont mises en contact, des électrons circulent de la bille vers la tige. Le nombre de charges négatives (électrons de la bille) a donc diminué.
Par contre, cette bille a conservé son nombre normal de charges positives (protons). La bille a maintenant plus de protons que d'électrons, elle possède donc une charge nette positive.
Décharge statique Une décharge statique survient lorsque le champ électrique de force (figure 1-3) entre une charge positive et une charge négative devient trop intense. Alors des électrons sont arrachés de l'objet chargé négativement et circulent à travers l'air vers l'objet chargé positivement.
On observe une étincelle. Elle est due à l'ionisation et à la désionisation de l'air compris entre les objets. Lorsque l'air est ionisé, les électrons sont élevés à un niveau d'énergie supérieur.
Lorsque l'air est désionisé, les électrons reviennent à un niveau d'énergie inférieur. Lorsque les électrons reviennent à leur niveau d'énergie inférieur, la différence entre les deux niveaux d'énergie donne naissance à une énergie lumineuse.
L'éclair est une colonne d'air ionisé causée par des électrons circulant d'un nuage chargé négativement vers le sol chargé positivement.
Applications de l'électricité statique
La plupart des applications utiles de l'électricité statique ne reposent pas sur les décharges qui ionisent l'air. Elles font plutôt usage de la force d'attraction entre des charges opposées ou font usage de la force de répulsion entre des charges semblables.
Ces forces sont utilisées pour déplacer des particules chargées vers des endroits voulus. Par exemple, l'air peut être débarrassé de ses particules poussiéreuses par cette méthode.
À la figure 1-7, l'air est forcé de passer entre des tiges chargées négativement et des armatures chargées positivement. Une charge négative est transférée des tiges aux particules de poussière.
Figure 1-7 Principe d'un précipitateur de poussières. Les particules de poussière reçoivent une charge négative de sorte qu'elles sont attirées vers les armatures chargées positivement.
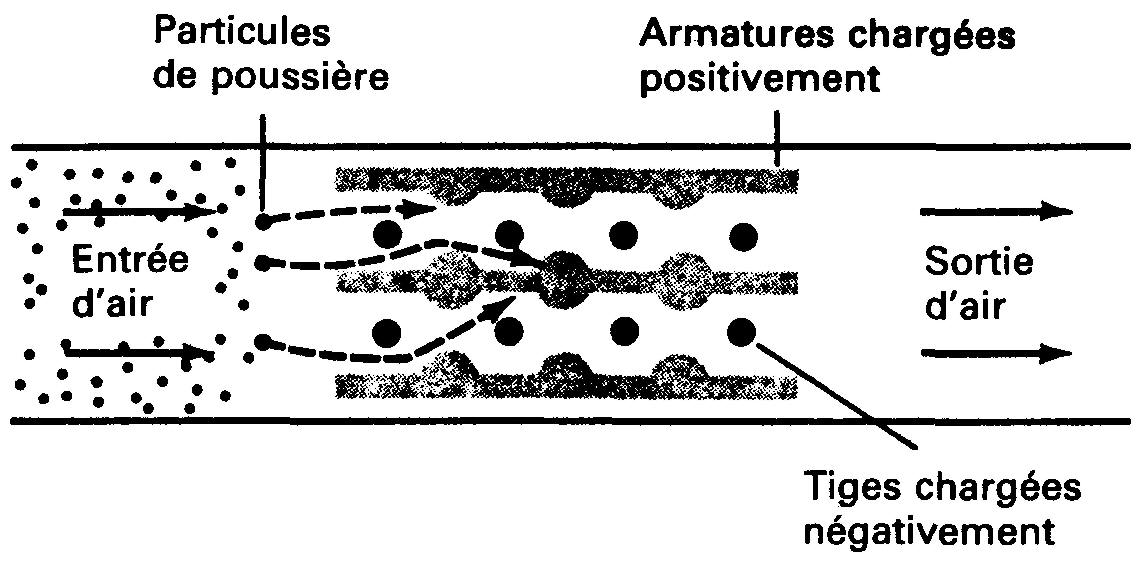
Les particules de poussière chargées négativement sont extraites lorsque le jet d'air circule sur les armatures chargées positivement. Les dispositifs électriques de ce type sont appelés des précipitateurs électrostatiques.
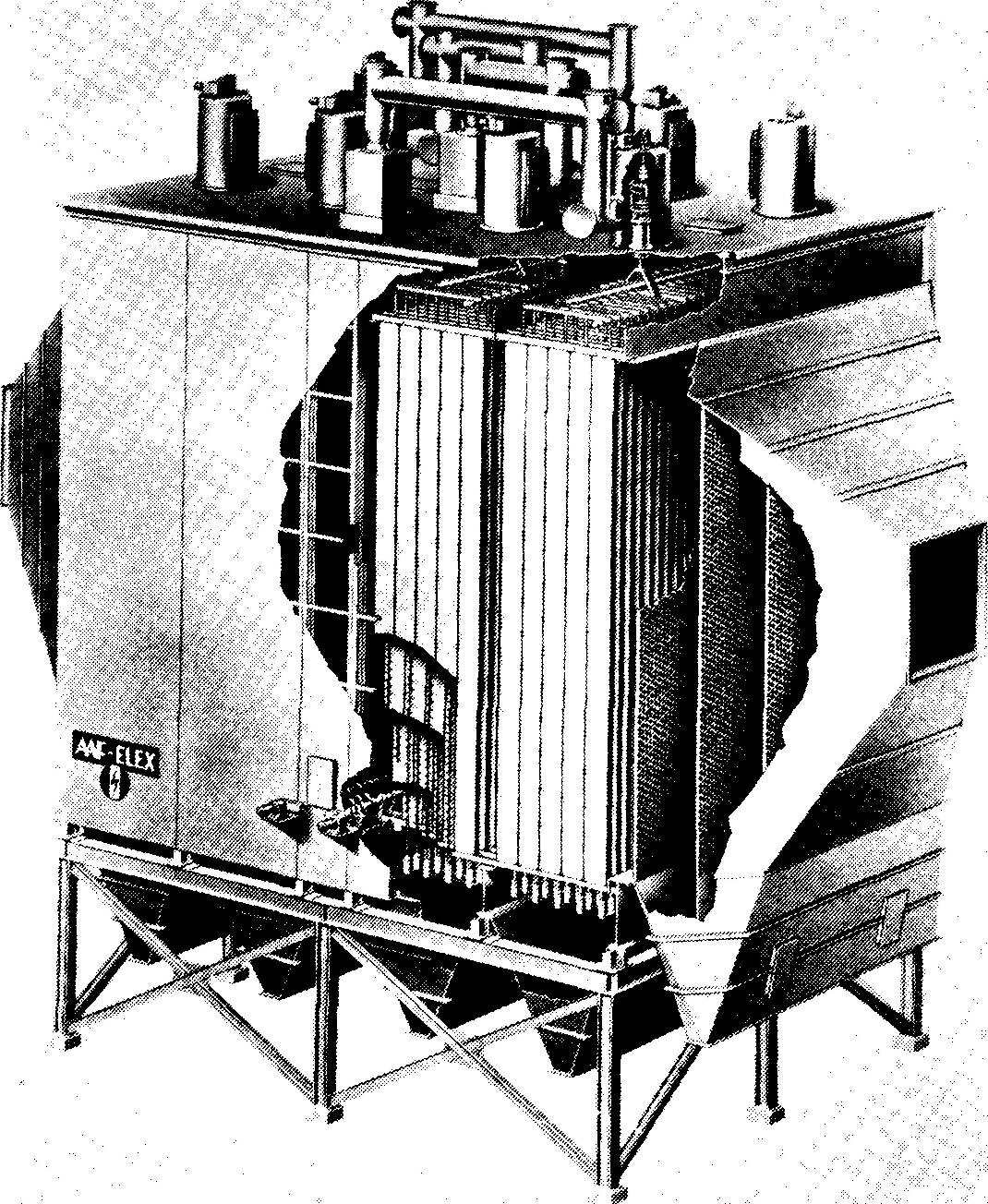
La figure 1-8 représente un tel précipitateur électrostatique. La vue en coupe fait apparaître les tiges et armatures chargées.
Figure 1-8 Vue en coupe d'un précipitateur électrostatique. (American Air Filter)
Les charges statiques sont également utilisées dans certaines opérations de peinture par pulvérisation. La peinture qui sort du gicleur du pulvérisateur est chargée négativement et l'objet à peindre est chargé positivement.
Ce procédé donne une couche uniforme de peinture sur un objet de surface irrégulière. La charge de la partie de l'objet peinte est annulée.
La force d'attraction disparaît. Si une partie de l'objet reçoit un excès de peinture, alors elle devient négativement chargée et repousse toute peinture additionnelle. La peinture repoussée est attirée vers les parties de l'objet qui sont encore positivement chargées.
Plusieurs propriétés de l'électricité statique sont mises à profit pour la fabrication du papier abrasif (papier de verre). Le papier de support est recouvert d'un adhésif (colle) et reçoit une charge statique. Les particules abrasives reçoivent la charge opposée.
À mesure que le papier défile au-dessus des particules abrasives, celles-ci sont attirées vers le papier et y adhèrent (figure 1-9).
Figure 1-9 Principe de fabrication du papier abrasif. Les charges statiques positionnent les particules abrasives de telle sorte que leurs pointes les plus acérées constituent la surface de coupe.
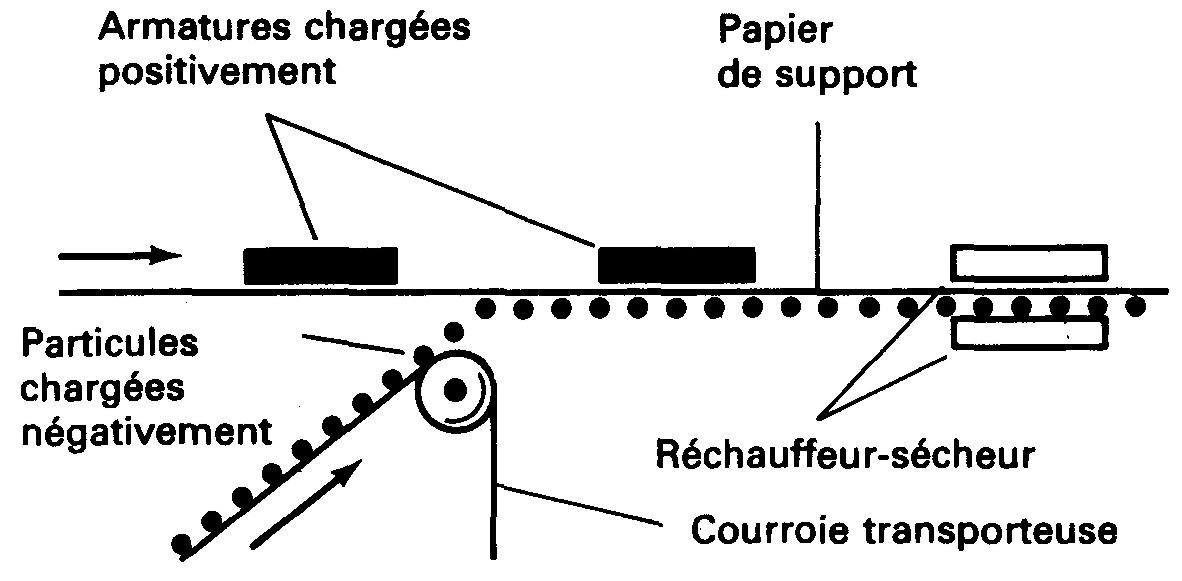
Une fois les particules abrasives réparties sur le papier de support adhésif, le papier et les particules abrasives possèdent des charges semblables. Ces charges se repoussant, elles essaient de rejeter les particules abrasives hors du papier.
L'adhésif est cependant assez fort pour retenir des particules au papier. Les particules abrasives se dressent alors sur le papier de sorte que leurs pointes acérées constituent la surface de coupe.
La substance adhésive est ensuite chauffée et durcie pour maintenir les particules abrasives en place. Les particules abrasives se dressent parce que les charges statiques se concentrent à la pointe acérée d'un objet.
Comme les charges semblables se repoussent, ces pointes se repousseront aussi loin que possible. Les pointes acérées des particules abrasives seront les parties les plus fortement chargées des particules. Elles seront donc repoussées le plus loin possible de la surface du papier de support.
Problèmes pratiques 1.5 (réponses à la fin du chapitre)
(a) Qu'est-ce qu'une charge statique?
(b) Quelle particule atomique est transmise d'un objet à un autre lorsqu'une décharge statique survient?
(c) Donner deux applications industrielles des charges statiques.
1.6
UNITÉ DE CHARGE, COURANT ET
PORTEURS DE COURANT, COURANT DANS LES SOLIDES,
UNITÉ D'INTENSITÉ DE COURANT:
L'AMPÈRE
Unité de charge
L'unité de base de charge électrique est le coulomb. Un coulomb est la quantité de charge possédée par:
6,25 x 1018 (6 250 000 000 000 000 000) électrons
Nous n'utilisons pas la charge d'un seul électron comme unité de base car c'est une charge beaucoup trop petite — trop petite pour la plupart des applications pratiques.
Le coulomb, unité de base de charge, sert également à définir les unités de base des autres grandeurs électriques, telles que l'intensité et la tension. Le coulomb tire son nom de celui d'un physicien français, Charles-Auguste Coulomb.
En électricité, nous utilisons de nombreux symboles pour les grandeurs et les unités électriques.
Le symbole de la charge est Q.
L'abréviation de coulomb est C.
L'usage de symboles électriques nous permet de condenser les idées et les énoncés. Par exemple, au lieu d'écrire «la charge est de cinq coulombs», nous pouvons simplement écrire «Q = 5C».
Courant et porteurs de courant Le courant électrique est le déplacement de particules chargées dans un sens spécifique. La particule chargée est soit un électron, soit un ion positif, soit un ion négatif.
La particule chargée est souvent appelée un porteur de courant. Le mouvement de la particule chargée s'effectue à travers un solide, un gaz, un liquide ou à travers le vide.
Dans un solide, comme par exemple un fil de cuivre, la particule chargée (porteur de courant) est l'électron. Les ions d'un fil de cuivre ou d'autres solides sont fortement retenus en place par la structure (cristalline) atomique de la substance.
Dans les substances solides les ions ne peuvent donc être des porteurs de courant. Par contre, dans les gaz et dans les liquides, les ions sont libres de se déplacer et de devenir des porteurs de courant.
Le symbole de l'intensité du courant ou tout simplement du courant est I. Le symbole I a été adopté par les premiers scientifiques qui parlaient de l'intensité de l'électricité dans un fil.
Courant dans les solides
Pour les courants dans les liquides et les gaz, voir la section 10.10 chapitre 10.
II importe, lorsque nous pensons au courant, de conserver deux points présents à l'esprit. Tout d'abord, que l'effet du courant est presque instantané. Le courant circule dans un fil à une vitesse proche de celle de la lumière:
3 x 108 m/s.
En second lieu, que les électrons se déplacent beaucoup plus lentement que l'effet du courant. Le temps de déplacement d'un électron le long d'un fil de quelques mètres peut être de plusieurs minutes.
La figure 1-10 illustre les deux points soulignés ci-dessus:
(a) l'effet du courant est instantané;
(b) les électrons se déplacent beaucoup plus lentement. Soit un très long tube de carton de diamètre juste suffisant pour le passage d'une balle de tennis.
Figure 1-10 Illustration de la vitesse apparente de déplacement des balles. Une balle sort du tube à l'instant où une autre balle y entre.
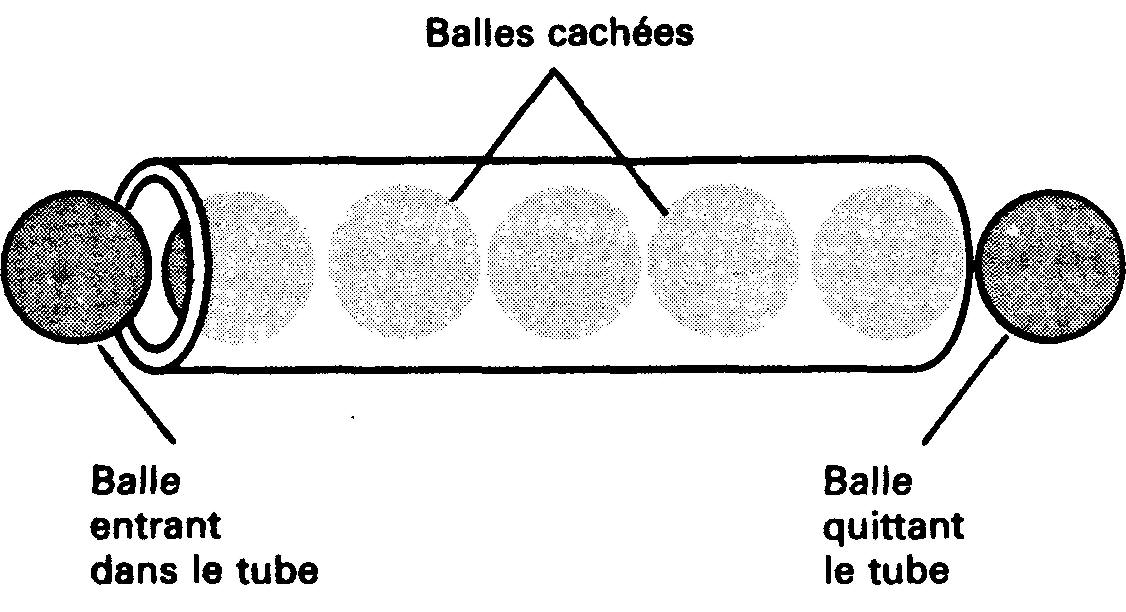
Posons le tube sur le plancher et remplissons-le de balles de tennis. Lorsque nous poussons une balle supplémentaire à une extrémité du tube, une autre balle sort immédiatement à l'autre extrémité du tube (figure 1-10).
Si nous ne savions pas que le tube était complètement rempli de balles de tennis, nous aurions pu penser que la balle de tennis introduite à une extrémité du tube le parcourait très rapidement et apparaissait à l'autre extrémité.
Cet effet (le déplacement des balles de tennis d'une extrémité à l'autre du tube) est très rapide. Chaque balle de tennis ne parcourt cependant qu'une courte distance.
Considérons l'empilage de six tubes remplis de balles illustré à la figure 1-11.
Figure 1-11 Illustration du déplacement des électrons.
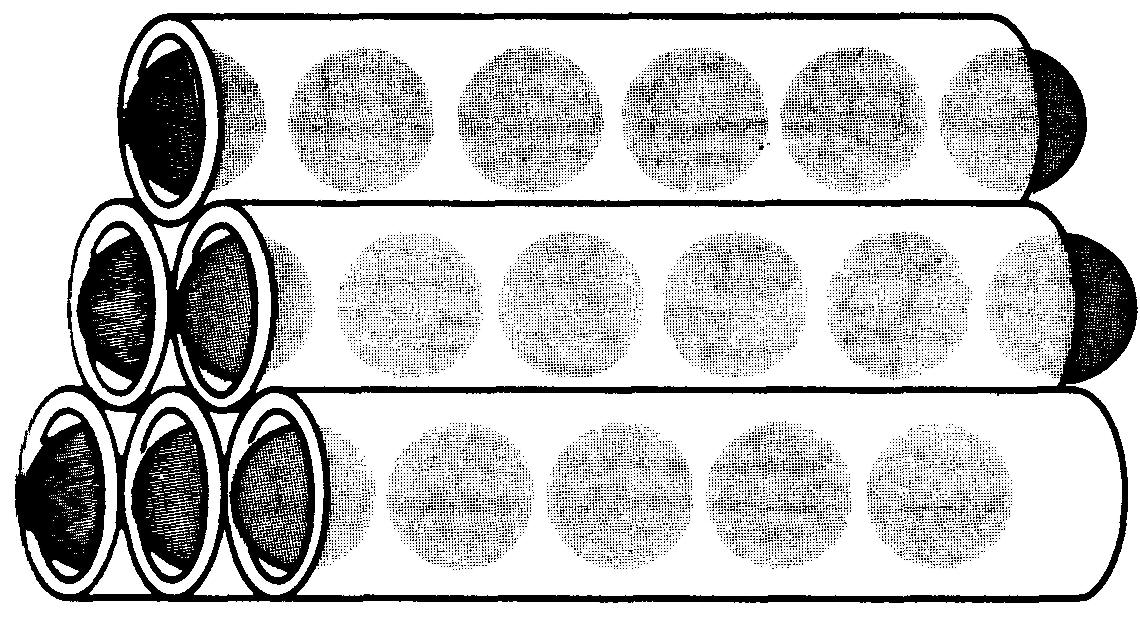
Introduisons successivement une balle dans chacun de ces tubes. Nous pourrions maintenant obtenir un débit continu de balles à l'autre extrémité des tubes.
Cependant seules les balles d'un tube pourraient s'être déplacées instantanément. Même à l'intérieur de ce tube, chaque balle n'aurait parcouru qu'une courte distance. Ce phénomène est comparable à la façon selon laquelle les porteurs de courant (électrons) se déplacent le long d'un fil lorsque le courant y circule.
Supposons que nous puissions observer les atomes et leurs particules à l'intérieur d'un fil d'aluminium (figure 1-12).
Figure 1-12 Courant dans un solide. Un électron libre ne parcourt qu'une courte distance avant de se combiner à un ion positif.
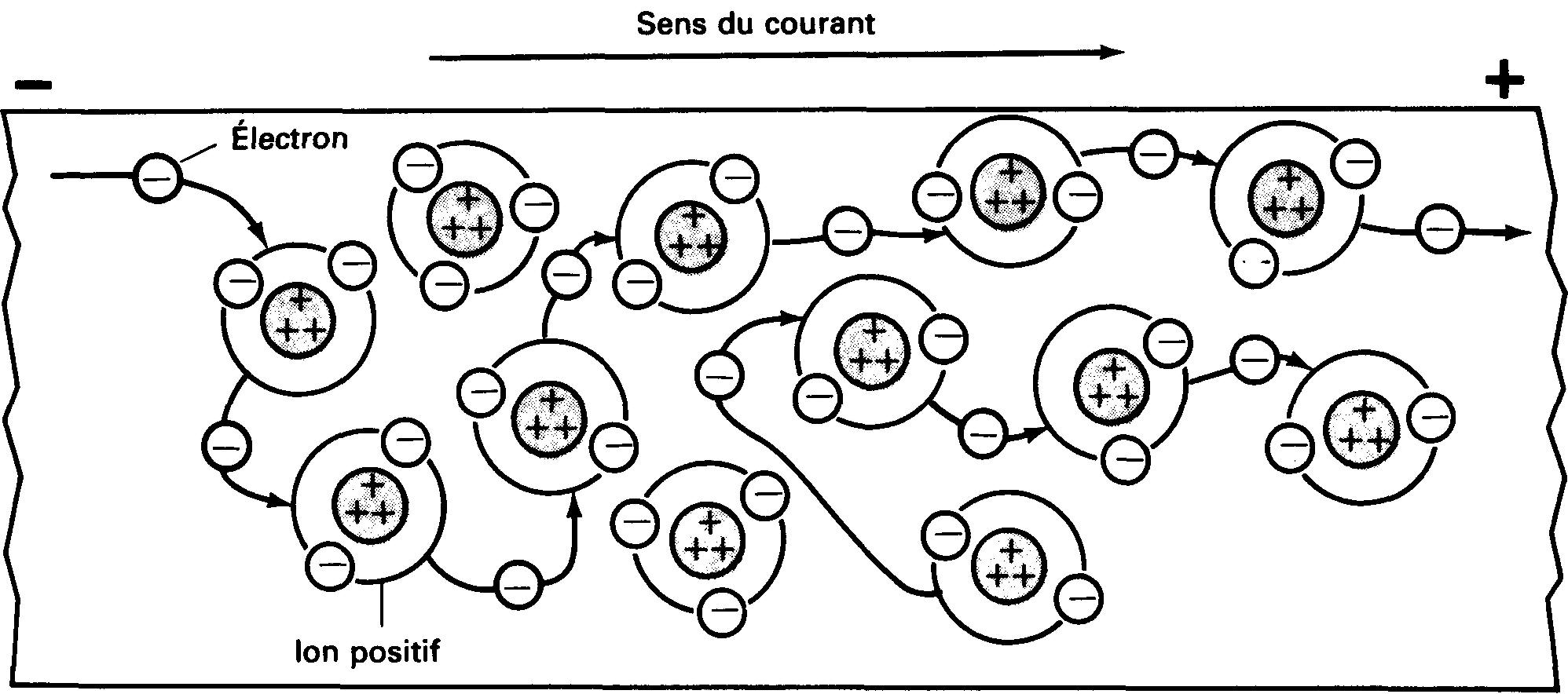
En réalité, l'atome d'aluminium comporte 13 électrons et 13 protons; mais par souci de simplicité, nous n'avons représenté que trois électrons et trois protons pour chaque atome. Supposons maintenant que les extrémités du fil sont reliées à une pile de lampe de poche.
Cette pile appliquera un champ électrique le long du fil.
Ce champ électrique libérera quelques-uns des électrons de valence, comme cela est illustré à la figure 1-12, en leur donnant une énergie supplémentaire.
A l'instant de sa libération, un électron peut circuler dans un sens opposé à celui du courant principal. Cependant, en présence du champ électrique, il changera aussitôt le sens de son déplacement. Chaque électron libéré engendre un ion positif. Cet ion positif exercera une attraction sur un électron.
Et, éventuellement, un des électrons libres passera à proximité du ion positif qui le capturera et deviendra de ce fait un atome neutre.
Remarquons qu'un électron n'est à l'état libre que durant un court instant et qu'il ne pourra parcourir, dans cet état, toute la longueur du conducteur. Il ne parcourt donc qu'une courte distance le long du fil avant d'être capturé par un des ions positifs.
Ce même électron peut, un peu plus tard, recevoir de nouveau assez d'énergie pour se libérer de son nouvel atome. Il continuera alors sa progression le long du fil comme électron libre. Nous pouvons donc imaginer que les électrons parcourent le conducteur en sautant d'atome en atome.
Si, pour chaque nouvel électron libre engendré, un électron libre est capturé, le nombre net d'électrons libres se déplaçant le long du fil reste constant. Le courant continuera de circuler. Il continuera de circuler dans le même sens à travers le conducteur.
Le courant qui circule tout le temps dans le même sens est appelé un courant continu, en abrégé ce. C'est ce type de courant que fournissent les piles de lampes de poche et les batteries.
Rappelons-nous que les électrons circulent d'un ion à l'autre plutôt lentement, cela nous permettra de comprendre le courant alternatif. Le courant dont nous disposons à la maison et à l'école est le courant alternatif, en abrégé ca.
Ce type de courant inverse périodiquement le sens de son déplacement. Le courant circulant dans tous les fils des maisons inverse son sens tous les 1/120 d'une seconde. Certains courants de téléviseurs inversent leur sens tous les 1/67 000 000 d'une seconde.
Pour mieux visualiser ces courants qui inversent leur sens, imaginer que leurs électrons sautent d'avant en arrière entre plusieurs ions.
Unité d'intensité de courant: l'ampère
Nous avons développé jusqu'à présent le concept de courant électrique.
Nous allons maintenant développer celui de l'unité d'intensité de courant.
La méthode la plus simple serait de considérer le nombre d'électrons ou coulombs qui circulent le long du conducteur. Cette méthode laisserait cependant beaucoup trop à désirer. Elle ne tiendrait pas compte du temps requis par le déplacement de la charge.
Ce serait, en quelque sorte, comparable au calcul de la circulation des voitures sans tenir compte du temps. Par exemple, sur une autoroute 1000 voitures peuvent passer à un point donné en une heure.
Par contre, sur une route de campagne à deux voies de circulation, 1000 voitures peuvent passer par un point donné en 20 h.
De toute évidence, la circulation est plus importante sur l'autoroute. Une façon plus intelligente de comparer la circulation sur ces deux routes est de considérer le nombre de voitures par heure.
Selon cette méthode, la circulation sur l'autoroute est de 1000 voitures par heure tandis que la circulation sur la route à deux voies est de 50 voitures par heure.
En électricité, l'intensité du courant s'exprime en fonction de la charge et du temps pris par cette dernière pour passer par un point donné.
L'intensité de courant électrique s'exprime donc en coulombs par seconde.
Mais comme cette expression, coulombs par seconde, est longue à énoncer, l'unité de base du courant a reçu le nom de ampère.
Un ampère est égal à un coulomb par seconde. Ce nom de ampère a été choisi comme unité de base du courant en l'honneur de André Marie Ampère, scientifique français qui accomplit certaines recherches fondamentales dans le domaine de l'électricité.
L'abréviation de ampère est A.
Pour indiquer que le courant circulant dans un fil est de 10 ampères, nous écrirons donc I= 10 A.
Remarquons que notre définition de l'ampère implique le temps. En électricité, le symbole du temps est t.
L'unité de base du temps est la seconde qui s'écrit en abrégé s. La relation entre le temps, la charge et le courant est:
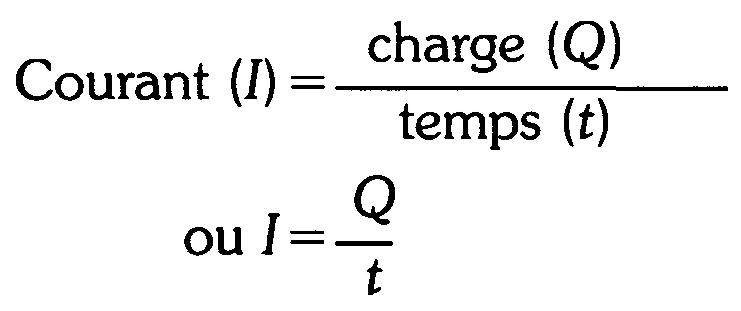 (1.2)
(1.2)
Problèmes pratiques 1.6 (réponses à la fin du chapitre)
(a) Quel est le symbole de la charge?
(b) Quelle est l'abréviation de coulomb?
(c) Qu'entend-on par courant électrique?
(d) Quel est le symbole du courant?
1.7 TENSION, ÉNERGIE, TRAVAIL, FORCE ET LEURS UNITÉS, UNITÉ DE TENSION: LE VOLT
Tension La tension est la pression électrique qui oblige le courant à circuler. La tension est également connue sous l'appellation force électromotrice (en abrégé f.é.m.), ou différence de potentiel.
Tous ces termes désignent la même chose, en l'occurrence la force qui met les charges en circulation. Le vocable différence de potentiel est le plus descriptif car une tension est en réalité une différence d'énergie potentielle qui existe entre deux points.
Le symbole de la tension est V.
Pour bien comprendre ce qu'on entend par tension, il importe tout d'abord de comprendre ce qu'on entend par énergie potentielle et différence d'énergie potentielle. Nous devons par conséquent parler d'énergie et donc de travail.
Énergie, travail, force et leurs unités
L'énergie est l'aptitude ou la capacité d'effectuer un travail.
Le fait, par exemple, de tirer un canot à rames hors de l'eau pour l'amener sur le rivage requiert le déploiement d'une certaine énergie.
Cette action a naturellement provoqué l'accomplissement d'un certain travail. Il faut, pour effectuer un travail, dépenser de l'énergie. Le symbole du travail et de l'énergie est W.
Dans le cas de l'amenée du canot sur la plage, l'énergie est corporelle.
Le travail consiste à déplacer une force sur une certaine distance. La force sert à surmonter la friction et la gravitation.
Dans le cas cité ci-dessus, la force déployée a surmonté la friction du canot sur le sable et la force de gravitation exercée sur le canot. La force de gravitation est apparue au moment où l'on a soulevé le canot au-dessus du niveau de l'eau.
L'unité de base de l'énergie est le joule, de symbole J. Une énergie (ou un travail) d'un joule est une très petite énergie comparativement à celle que l'on met en jeu chaque jour.
Ainsi, un grille-pain électrique consomme une énergie d'environ 100 000 J pour griller deux tranches de pain. Une lampe de bureau de 100 W consomme 360 000 J/h.
Le travail (ou l'énergie) mis en oeuvre dans un système mécanique (comme l'amenée d'un canot sur la plage) est déterminé par l'expression suivante:
Travail (W) = force x distance
L'unité de base de la force (F) est le newton, symbole N, celle de la distance (I) est le mètre, symbole m, et celle du travail (ou de l'énergie) est le joule, symbole J; le joule est égal à un newton-mètre, une unité commode pour l'énergie mécanique.
Il existe deux types d'énergie: l'énergie potentielle et l'énergie cinétique.
L'expression énergie cinétique se rapporte à une énergie en mouvement, ou à une énergie accomplissant un certain travail, ou encore à une énergie transformée d'une forme en une autre.
Le balancement d'un bâton de base-bail lui procure une certaine énergie cinétique.
Le bâton accomplit un certain travail lorsqu'il frappe la balle; c'est-à-dire qu'il exerce une force sur la balle qui, de ce fait, parcourt une certaine distance. Tout objet en mouvement ayant une certaine masse possède de l'énergie cinétique.
L'énergie potentielle est l'énergie au repos.
Sous cette forme, elle peut être emmagasinée durant de longues périodes. Elle est en mesure d'accomplir un certain travail lorsque nous lui fournissons les conditions adéquates pour la transformer de sa forme emmagasinée en une autre forme.
Naturellement, durant ce processus de transformation, elle passe de la forme potentielle à la forme cinétique.
L'eau emmagasinée dans un lac et retenue par un barrage d'une usine hydro-électrique possède de l'énergie potentielle due à la force de gravitation.
L'énergie potentielle de l'eau peut être emmagasinée durant de longues périodes. Dans le cas d'une demande d'énergie, on transforme cette énergie potentielle en énergie cinétique en laissant l'eau s'écouler vers l'usine hydro-électrique.
Une charge électrique possède de l'énergie potentielle. Lorsqu'on marche sur un tapis, on recueille une charge électrique sur soi. Cette charge (électricité statique) est de l'énergie potentielle.
Si par la suite on touche un
certain objet, il s'ensuit une étincelle. L'énergie potentielle devient de
l'énergie cinétique car la charge électrique est transformée en énergie
lumineuse et en énergie thermique de l'étincelle.
Un objet, par exemple
un livre au repos sur une table, possède également de l'énergie potentielle. Ce
livre est capable d'accomplir un certain travail, par exemple lorsqu'il se
déplace de la table au plancher.
Il possède donc de l'énergie potentielle par rapport au plancher. Lorsqu'il tombe effectivement de la table vers le plancher, son énergie potentielle est transformée en énergie mécanique et en énergie thermique. L'énergie potentielle dépend de la masse.
Si nous remplaçons ce livre par un objet de plus grande masse, alors l'énergie potentielle augmente. La différence d'énergie potentielle est indépendante de la valeur de la masse. Elle est fonction de la distance entre les deux surfaces et de la force de gravitation.
Nous pouvons également imaginer la situation inverse et considérer l'énergie requise pour déplacer la masse du plancher à la table. La différence d'énergie potentielle est la même dans les deux cas.
Dans un cas, on retire de l'énergie du système; dans l'autre, on ajoute de l'énergie dans le système. C'est-à-dire qu'on accomplit un certain travail en portant le livre du plancher à la table.
Dans notre discussion d'énergie potentielle nous n'avons, jusqu'à présent, traité que d'exemples mécaniques.
Dans ces exemples, l'énergie potentielle de l'objet et la différence d'énergie potentielle entre le plancher et la table sont dues à la masse et à la force de gravitation. En électricité, l'énergie potentielle et la différence d'énergie potentielle sont dues aux champs électriques et aux charges électriques.
La tension est une différence d'énergie potentielle semblable au cas mécanique discuté ci-dessus. Au lieu de déplacer des masses grâce à la force de gravitation, les charges électriques sont, quant à elles, déplacées grâce à la force d'un champ électrique.
Considérons la figure 1-13: la charge de l'électron «perd» de l'énergie à mesure qu'elle se déplace d'un point chargé négativement à un point chargé positivement (de la même façon que le livre perdait de l'énergie à mesure qu'il se déplaçait de la table vers le plancher).
Figure 1-13 Charge se déplaçant à travers un champ électrique. Une partie de l'énergie de l'électron est transformée en une autre forme d'énergie.
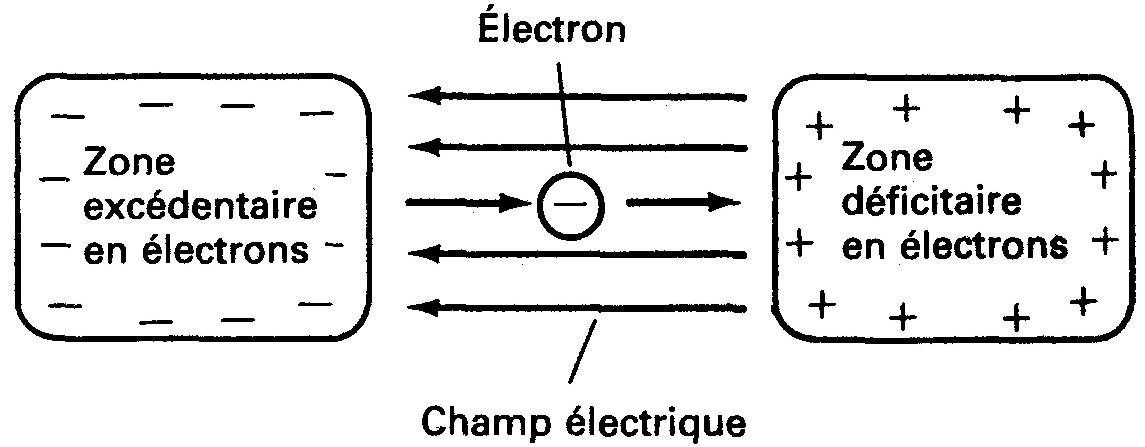
L'énergie «perdue» de la charge pourrait être transformée en chaleur et lumière, ce qu'accomplit la charge qui se déplace à travers une ampoule.
Il existe une tension (différence d'énergie potentielle) entre les zones négative et positive illustrées à la figure 1-13.
Ces zones négative et positive pourraient représenter les bornes d'une batterie électrique. Une batterie au plomb comme celle illustrée à la figure 1-14 est une source habituelle de tension.
Figure 1-14 Batterie au plomb. (Exide Power Systems)

Une différence d'énergie potentielle (tension) existe entre les bornes négative et positive d'une batterie.
Cette tension est le résultat d'un excès d'électrons à la borne négative et d'une déficience en électrons à la borne positive. Un certain travail est accompli lorsque les électrons se déplacent de la borne négative à la borne positive de la batterie.
De l'énergie est extraite de la batterie et transformée en une autre forme.
À l'exemple du système mécanique, le système électrique peut lui aussi être inversé. C'est-à-dire que la charge des électrons peut augmenter d'énergie lorsqu'elle se déplace du point chargé positivement au point chargé négativement.
Ceci survient lors du chargement d'une batterie. Le chargeur de batterie oblige des électrons à parcourir la batterie dans le sens inverse.
Unité de tension: le volt
II nous faut une unité de base pour indiquer la différence d'énergie potentielle (tension) entre deux points comme, par exemple, les bornes d'une batterie. Cette unité doit spécifier l'énergie disponible lorsqu'une charge donnée est transportée d'un point négatif à un point positif.
Nous avons déjà l'unité de base d'énergie, le joule, et l'unité de base de charge, le coulomb. L'unité de base de la tension sera donc le joule par coulomb. Le joule par coulomb est appelé le volt.
Le volt est l'unité de base de la tension. Son abréviation est V.
La batterie illustrée à la figure 1-14 est une batterie de 48 volts. Sous forme symbolique, nous indiquerons que la tension de cette batterie est V = 48 V.
La différence de potentiel (tension) de 48 V signifie que chaque coulomb de charge fournira 48 J d'énergie.
Par exemple, un coulomb circulant à travers une lampe transformera 48 J de l'énergie de la batterie en énergie thermique et en énergie lumineuse.
La relation entre la charge, l'énergie et la tension s'exprime sous la forme suivante:
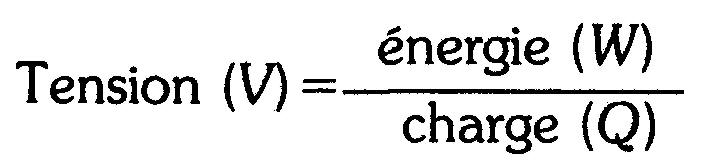 (1.3)
(1.3)
ou, selon le réarrangement:
W = V x Q (1.4)
Cette relation permet de déterminer l'énergie électrique de la même façon que l'énergie mécanique qui fut obtenue plus haut.
Exemple 1
Déterminer l'énergie potentielle {W) d'une batterie de 6 volts (6 V) dont la charge emmagasinée (Q) est de 3000 C.
Réponse
W = V x Q = 6V x 3000C C = 18 000 J
Remarquer à l'exemple 1 que la multiplication de volts par des coulombs donne des joules.
Cela est dû au fait qu'un volt est un joule par coulomb et donc les coulombs s'annulent:
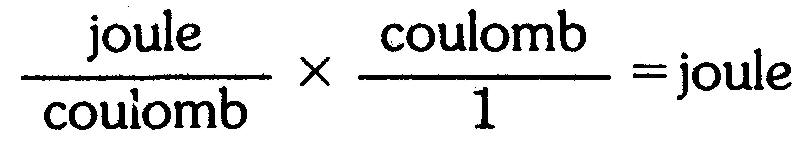
Problèmes pratiques 1.7 (réponses à la fin du chapitre)
(a) Quels sont les symboles de: énergie, travail, force, tension?
(b) Quelles sont les unités de: énergie, travail, force, tension?
(c) Déterminer l'énergie potentielle d'une batterie de 12 V dont la charge emmagasinée est de 12 000 C.
1.8
RÉSISTANCE, CONDUCTEURS, ISOLANTS, SEMI-CONDUCTEURS, UNITÉ DE RÉSISTANCE: L'OHM,
COEFFICIENT DE TEMPÉRATURE, RÉSISTIVITÉ, COMPOSANTS RÉSISTANTS, CONDUCTANCE
L'opposition qu'une substance offre au passage du courant est appelée sa résistance.
Le symbole de la résistance est R.
Toutes les substances offrent une certaine résistance au passage du courant.
Cependant, l'éventail de résistances offertes par les différentes substances est extrêmement large. Il est plus difficile d'obtenir des électrons libres (porteurs de courant) de certaines substances que d'autres.
Les substances à résistance élevée requièrent, pour libérer un électron, davantage d'énergie que celles à faible résistance. La résistance d'une substance parcourue de force par un courant transforme l'énergie électrique en énergie thermique.
Conducteurs
Les substances offrant une très petite résistance (opposition) au passage du courant sont appelées des conducteurs. Le cuivre, l'aluminium et l'argent sont de bons conducteurs. Ils présentent une très faible résistance.
En général, les éléments dont la couche de valence contient trois électrons ou légèrement plus sont classés comme conducteurs.
Cependant, même parmi ces éléments classés comme conducteurs, il existe une large variation d'aptitude à la conduction du courant.
Le fer, par exemple, est près de six fois plus résistant que le cuivre, bien qu'ils soient considérés tous deux comme conducteurs.
D'autres considérations peuvent entrer en jeu. Ainsi l'argent conduit légèrement mieux que le cuivre, mais il est trop coûteux pour les applications ordinaires.
L'aluminium n'est pas un aussi bon conducteur que le cuivre, mais il coûte moins cher et est plus léger. De volumineux conducteurs d'aluminium sont utilisés pour acheminer l'énergie électrique aux maisons.
Isolants
Les substances offrant une résistance élevée au passage du courant sont appelées des isolants. Même le meilleur des isolants livre passage à un électron libre occasionnel qui sert de porteur de courant.
Cependant, dans la plupart des applications pratiques, nous pouvons considérer qu'un isolant est une substance qui ne permet le passage d'aucun courant.
Les substances isolantes habituelles utilisées dans les appareils électriques sont le papier, le bois, le plastique, le caoutchouc, le verre et le mica.
Remarquons que les isolants habituels ne sont pas des éléments purs. Ce sont des substances dans lesquelles deux éléments, ou plus, sont combinés ensemble pour former une nouvelle substance.
Le processus de combinaison est tel que ces éléments partagent leurs électrons de valence. Ce partage des électrons de valence est appelé liaison covalente. La libération d'un électron d'une liaison covalente réclame une grande énergie supplémentaire.
La figure 1-15 illustre une large variété d'isolateurs. Ces types d'isolateurs sont utilisés dans les dispositifs soumis à des températures élevées.
Figure 1-15 Isolateurs. {Foxboro Co.)

Semi-conducteurs
Entre ces extrêmes: conducteurs et isolants, il existe un groupe d'éléments appelés semi-conducteurs. Les éléments semi-conducteurs possèdent quatre électrons de valence.
Deux des meilleurs semi-conducteurs connus sont le silicium et le germanium. Les semi-conducteurs ne sont ni de bons conducteurs ni de bons isolants. Ils permettent la circulation d'un certain courant, mais ils présentent une valeur de résistance considérable.
Les semi-conducteurs sont des substances industrielles extrêmement importantes. Ils servent à la fabrication de composants électroniques comme les transistors, les circuits intégrés (CI) et les piles solaires.
Du fait de leur valence 4 et de leur structure cristalline, les semi-conducteurs comme le germanium et le silicium peuvent abandonner leur état neutre par addition de petites quantités d'impuretés.
Ces impuretés sont soit des atomes pentavalents (à cinq électrons de valence) soit des atomes trivalents (à trois électrons de valence).
Cette technique est appelée le dopage.
Les atomes pentavalents sont dits donneurs parce qu'ils produisent des électrons libres et l'on obtient par ce genre de dopage un semi-conducteur de type N, mis pour négatif.
Les atomes trivalents sont dits accepteurs parce qu'ils prennent des électrons libres, et l'on obtient par ce genre de dopage un semi-conducteur de type P, mis pour positif.
Une déficience de un électron dans le semi-conducteur est appelée une charge de un trou. On construit en combinant ces deux genres de dopage des transistors de type PNP ou NPN.
Unité de résistance: l'ohm
Nous avons discuté jusqu'à présent de la valeur de la résistance en termes de résistance faible et de résistance élevée. Il nous faut, pour travailler avec des circuits électriques, être capables d'établir la valeur de la résistance d'une façon plus spécifique.
L'unité utilisée pour spécifier la valeur d'une résistance est l'ohm. L'ohm est l'unité de base de la résistance. Le symbole d'abréviation de l'ohm est Ω (la lettre grecque capitale oméga).
L'unité de résistance est l'ohm, en l'honneur de Georg Ohm qui découvrit la relation entre le courant, la tension et la résistance.
L'ohm peut être défini de plusieurs façons différentes.
En premier lieu, c'est la valeur de résistance qui permet le passage d'un courant de 1 A lorsque la tension est de 1 V.
En deuxième lieu, c'est la valeur de la résistance d'une colonne de mercure de 106,3 cm de longueur, d'un millimètre carré de section à la température de 0°C.
De cette dernière définition d'un ohm, on peut voir que la valeur de la résistance d'un objet est déterminée par quatre facteurs:
(1) le type de substance dont l'objet est constitué;
(2) la longueur de l'objet;
(3) la surface transversale (largeur x hauteur) de l'objet;
et (4) la température de l'objet.
La valeur de la résistance d'un objet est directement proportionnelle à sa longueur et inversement proportionnelle à sa section transversale.
Par exemple, si la longueur d'un morceau d'un fil de cuivre est doublée, alors sa résistance sera elle aussi doublée (figure 1-16).
Figure 1-16 La résistance dépend de la longueur et de la section.
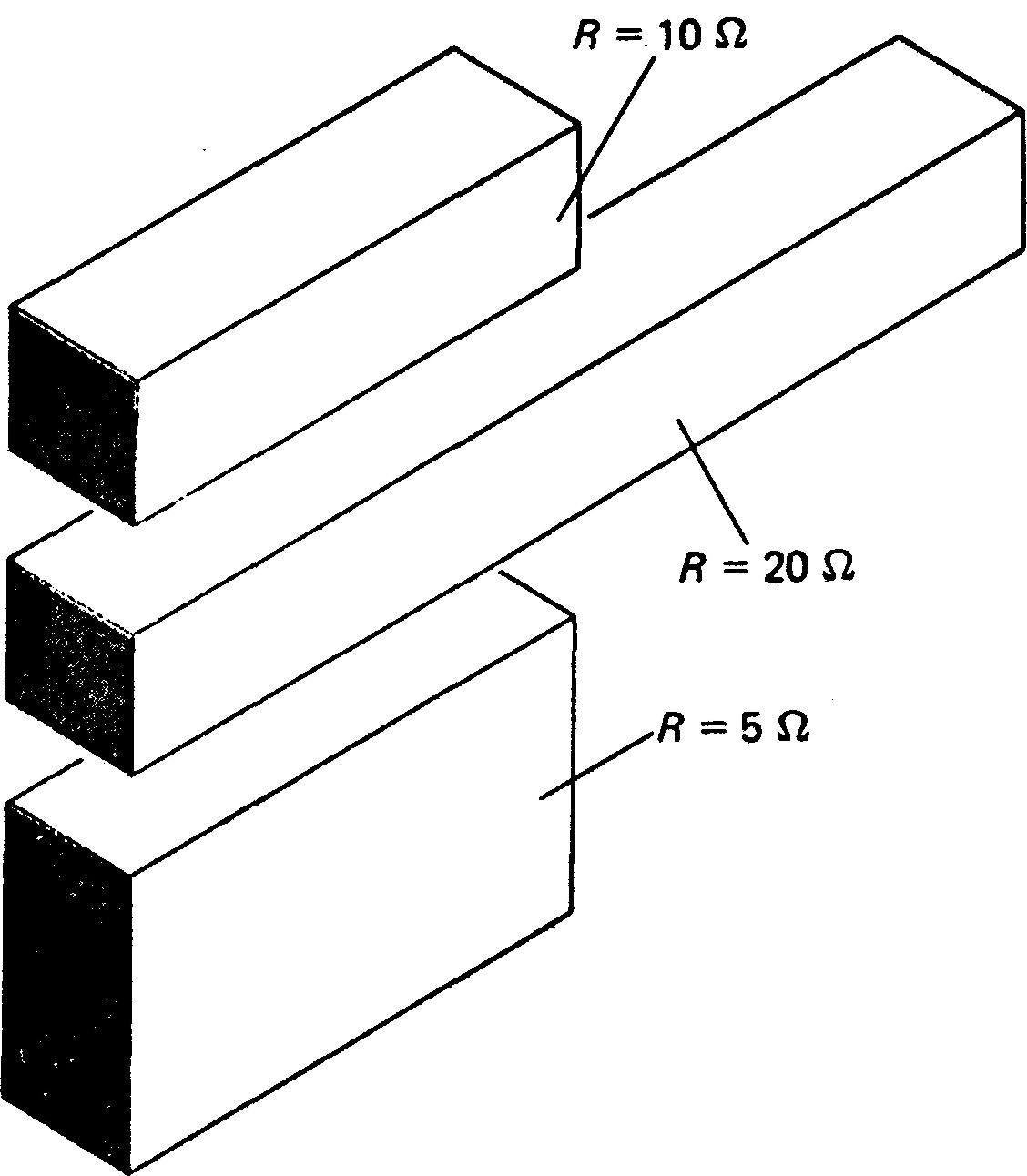
Si la section transversale du fil de cuivre est multipliée par deux, alors sa résistance sera la moitié de sa valeur antérieure. Les extrémités ombrées des conducteurs de la figure 1-16 sont les surfaces transversales des conducteurs.
Il n'existe aucune relation simple entre la résistance et la température.
La résistance de la plupart des substances augmente à mesure que leur température augmente. Cependant, pour quelques substances comme le carbone, la résistance décroît lorsque la température augmente.
Coefficient de température
La variation de résistance correspondant à une variation de température est connue sous le nom de coefficient de température de la résistance.
Chaque substance a son propre coefficient de température. Le carbone a un coefficient de température négatif, tandis que la plupart des métaux ont un coefficient de température positif.
Par définition, le coefficient de température est la variation en ohms par million d'ohms par degré Celsius, en abrégé 10-6 °C.
Le carbone, par exemple, a un coefficient de température négatif de 500 x 10-6 °C à 20°C.
Cela signifie qu'un morceau de carbone ayant une résistance de 1 000 000 a à 20°C aura une résistance de 1 000 500 Ω à la température de 19°C.
À 18°C, il présentera une résistance de 1 001 000 Ω.
Dans de nombreux dispositifs électriques et électroniques, les variations de résistance dues aux variations de température sont si petites qu'elles peuvent être ignorées.
Dans les dispositifs où les petites variations de résistance sont importantes, comme dans le cas des appareils de mesure électriques, des substances spéciales à faible coefficient de température sont utilisées. Une de ces substances est le constantan (un mélange de cuivre et de nickel).
Le constantan a un coefficient de température positif de 18 x 10-6 /°C à 20°C.
Remarquons que le coefficient de température est défini à une température spécifique. Cela signifie que le coefficient de température lui-même change avec la température.
Cependant, ces variations sont extrêmement petites dans la gamme de températures où fonctionnent la plupart des dispositifs électriques.
Résistivité
La résistance caractéristique d'une substance est donnée par sa résistivité.
La résistivité d'une substance est simplement la résistance (en ohms) d'un mètre cube de cette substance. Les valeurs nominales des résistivités nous permettent de comparer directement l'aptitude des diverses substances à conduire le courant.
La figure 1-17 illustre la méthode de détermination de la résistivité.
Figure 1-17 La résistivité égale la résistance entre la surface A et la surface B.
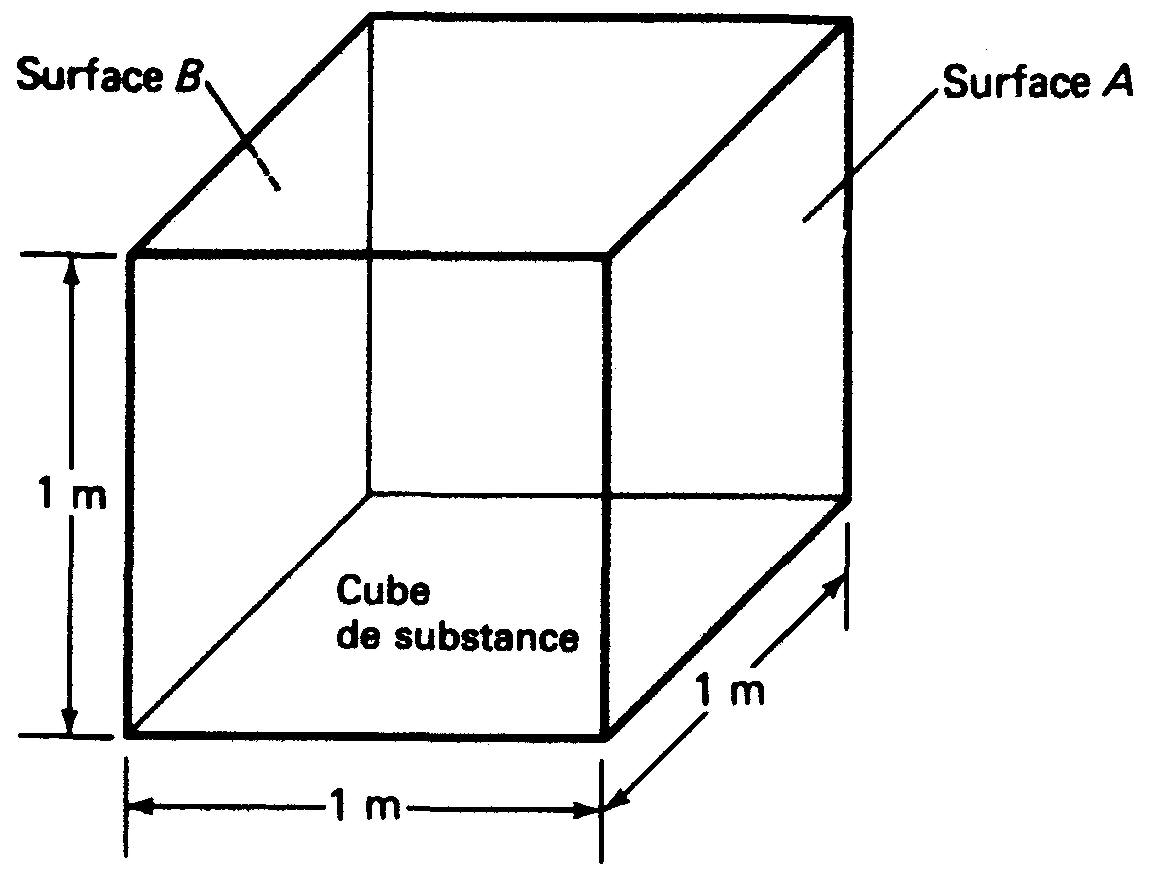
La résistivité s'exprime en ohm-mètre. Le cuivre recuit, par exemple, à 20°C a une résistivité de 17,2 x 10-9 (0,000 000 017 2) (Ω.m).
Ce qui signifie qu'un cube de cuivre de 1 m d'arête aura une résistance de 17,2 x 10-9 Ω entre deux quelconques de ses faces.
Plus la résistivité d'une substance est petite, plus cette substance est conductrice.
Le symbole de la résistivité est ρ (lettre grecque rhô).
La relation entre la résistance, la longueur, la surface transversale et la résistivité est donnée par la formule:
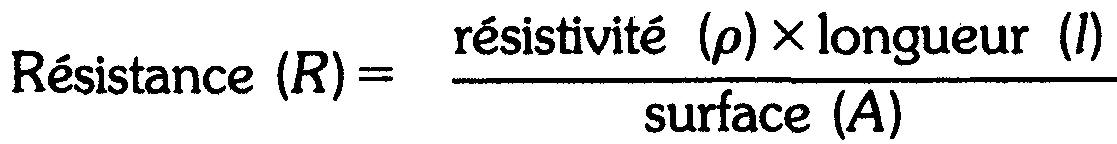
Ou, en utilisant seulement les symboles,
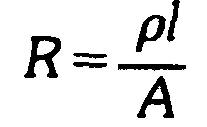
La résistance sera en ohms si toutes les autres grandeurs sont exprimées en unités de base, c'est-à-dire que si l'unité de la résistivité est l'ohm-mètre, celle de la longueur sera le mètre et celle de la surface, le mètre carré.
Exemple 2
Déterminer la résistance, à 20°C, d'un enroulement d'un moteur électrique qui utilise 200 m de conducteur de cuivre de 0,26 cm² de section. La résistivité du cuivre à 20°C est de 0,000 000 017 2 (Ω.m).
Réponse
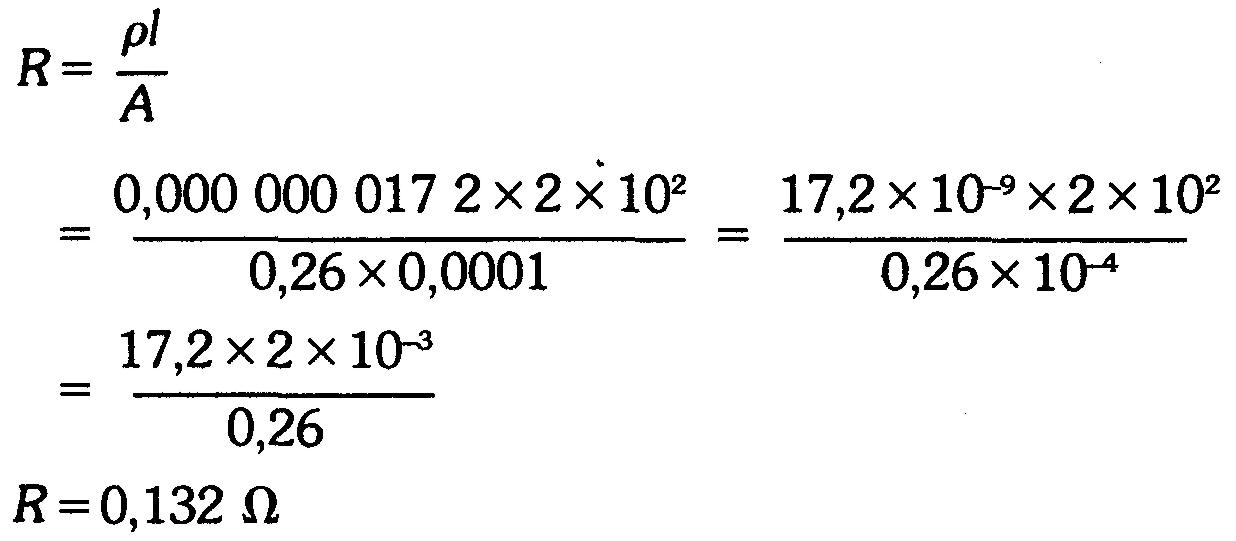
Composants résistants
Le terme résistance désigne non seulement la propriété physique que possèdent certaines substances de limiter le passage du courant électrique, mais aussi le composant électrique spécial assurant cette fonction.
Dans de nombreux dispositifs électriques et électroniques, la résistance des conducteurs est si petite par rapport à celle des autres constituants du dispositif qu'elle peut être ignorée. Dans la plupart des cas, la résistance des conducteurs n'est pas calculée ou est ignorée dans la conception du dispositif.
Cependant dans certains appareils, comme les récepteurs de radio et de télévision, de grandes valeurs de résistance sont nécessaires. Les résistances permettent de régler le courant.
Les résistances sont les composants physiques utilisés pour régler la valeur du courant dans un système électrique. Elles sont fabriquées dans une large variété de formes et de dimensions. Leurs valeurs vont de un ohm à plusieurs millions d'ohms.
Conductance
La conductance est l'inverse de la résistance.
Son symbole est G et son unité de base, le Siemens, en abrégé S.
Un composant ayant une résistance de 5Ω, par exemple, présentera donc une conductance de 0,2 S.
Problèmes pratiques 1.8 (réponses à la fin du chapitre)
(a) Dire dans quelle forme d'énergie est transformée l'énergie électrique d'un courant traversant une résistance.
(b) Quelle est l'unité de base de la résistance?
(c) Quel est le symbole utilisé comme abréviation de l'unité de base de la résistance?
(d) Convertir 20Ω en S.
(e) Définir l'unité de base de la résistance en fonction des unités de base de la tension et du courant.
(f) Énumérer les quatre facteurs qui déterminent la résistance d'un objet, (g) Quel est le rôle principal d'une résistance?
1.9 POLARITÉ, SOURCES D'ÉLECTRICITÉ, CIRCUIT FERMÉ, CIRCUIT OUVERT
Polarité
Le terme polarité est utilisé de plusieurs façons différentes.
On peut dire que la polarité d'une charge est négative ou on peut dire que la polarité d'une borne est positive. Nous pouvons également utiliser ce terme pour indiquer comment connecter les bornes négative et positive de dispositifs électriques.
La pose de nouvelles piles dans un poste de radio à transistors, par exemple, doit être effectuée selon une polarité correcte (figure 1-18).
Figure 1-18 La pose de nouvelles piles dans un poste de radio doit être effectuée selon une polarité correcte.
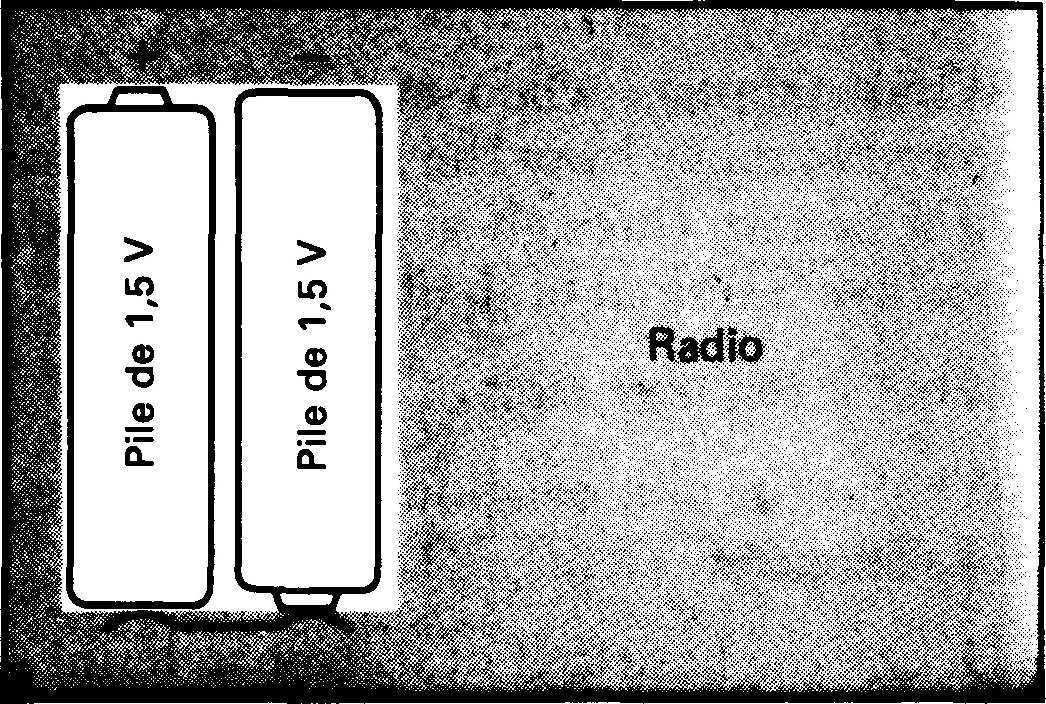
La borne positive de chaque pile est reliée à la borne positive du poste récepteur; les bornes négatives respectent une configuration semblable.
Les appareils électriques dont les bornes négative et positive sont identifiées sont appelés polarisés. Lorsqu'on connecte de tels appareils à une source de tension (comme une batterie), il importe de respecter le marquage de polarités.
Rappelons de nouveau que la borne négative de l'appareil doit être connectée à la borne négative de la source, et la borne positive de l'appareil à la borne positive de la source.
Si la polarité n'est pas respectée (c'est-à-dire une borne positive connectée à une borne négative), l'appareil ne fonctionnera pas et pourrait même être endommagé ou détruit.
Lors du soudage à l'arc électrique, le soudeur peut souder soit en polarité directe soit en polarité inverse. Ces expressions polarité directe, polarité inverse précisent que la borne négative ou la borne positive de la source de tension est reliée à la baguette de soudure.
Sources d'électricité
Les atomes de toutes les substances contiennent des protons et des électrons, mais pour effectuer un travail utile les charges doivent être séparées pour produire une différence de potentiel permettant la circulation d'un courant électrique.
Les méthodes les plus courantes de production des effets électriques apparaissent ci-dessous. Elles se classent en deux grandes familles selon leur mode de production.
Soit, tout d'abord, celle de production d'électricité statique comprenant le frottement, en particulier la génération selon le procédé Van de Graaff, et en second lieu celle de production d'électricité dynamique comprenant la transformation de l'énergie chimique, la production par effet magnétique et par effet électromagnétique, la photo-électricité et la piézo-électricité et l'émission thermoionique.
a) PRODUCTION D'ÉLECTRICITÉ STATIQUE
Friction
Dans cette méthode, les électrons d'un isolant sont arrachés par frottement, ce qui produira des charges opposées qui resteront dans le diélectrique.
Générateur Van de Graaff
On a souvent recours aux sources électrostatiques de haute tension pour les appareils servant à bombarder les atomes, surtout dans les expériences de physique nucléaire.
Le premier de ces appareils fut conçu par Robert J. Van de Graaff et développé ultérieurement avec son associé John G. Trump.
À la figure 1-19, on présente un diagramme considérablement simplifié de ce générateur.
Figure 1-19 Générateur Van de Graaff.
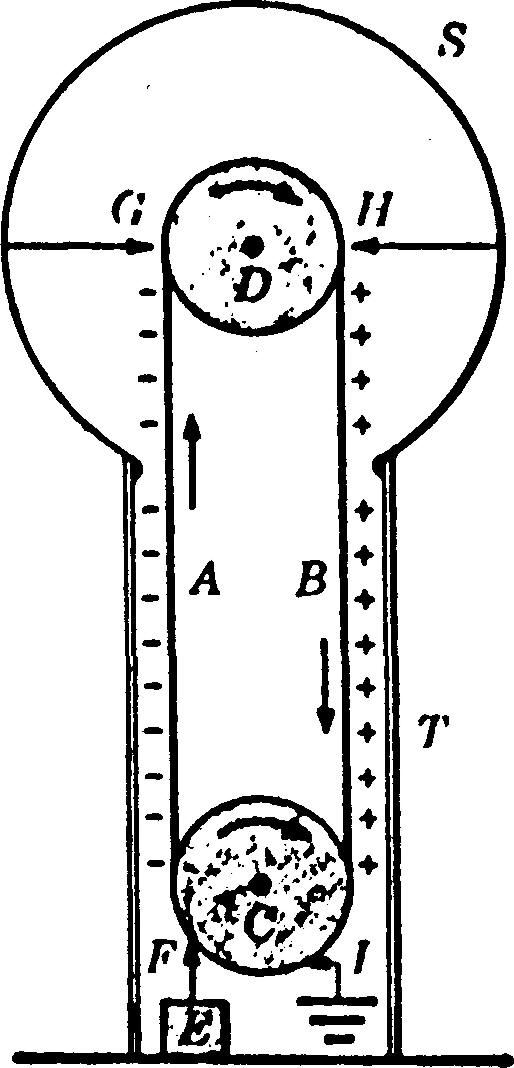
Une sphère métallique S est supportée par un tube isolant T.
Une large courroie AB faite de matière isolante est activée par un moteur commandant la poulie C; l'extrémité supérieure de la courroie passe par la poulie intermédiaire D.
Un certain nombre de pointes d'aiguilles en F est constamment tenu à un potentiel hautement négatif (10 à 50 kV) grâce à la source £; une décharge de couronne bombarde la courroie d'électrons à mesure qu'elle s'éloigne de C.
Une autre série de pointes en G transfère les électrons de la courroie à la sphère S, lui donnant ainsi une charge négative qui va sans cesse augmentant.
Une autre série de pointes d'aiguilles en H crée une grande différence de potentiel qui ionise l'air de cette région.
Les ions positifs sont attirés par la courroie et retournés vers le bas de l'appareil pour y être neutralisés par les électrons projetés sur la courroie depuis la série d'aiguilles I reliées à la terre.
Il y a ainsi un échange continuel d'électricité négative depuis le haut de l'appareil jusqu'à la sphère et un transport de charges positives depuis la sphère jusqu'au sol.
La sphère acquiert à la fin un potentiel négatif très élevé par rapport à celui du sol. Certains appareils de ce genre peuvent produire des différences de potentiels de 10 MV, des modèles commerciaux de différentes grandeurs sont disponibles pour des usages variés.
La limite du potentiel est déterminée par les pertes occasionnées par l'air ambiant et l'isolation des supports.
b) PRODUCTION D'ÉLECTRICITÉ DYNAMIQUE
Transformation de l'énergie chimique
Cette transformation a lieu dans les piles et les batteries à électrolyte sec ou liquide.
Dans ce cas, une réaction chimique produit des charges opposées sur deux métaux différents qui servent de bornes positive et négative.
Électromagnétisme
Électricité et magnétisme sont intimement liés.
À toute charge en mouvement est associé un champ magnétique.
Inversement, à toute variation de champ magnétique correspond un courant. Le moteur est un exemple de la façon dont réagit un courant en présence d'un champ magnétique pour produire un mouvement; une génératrice fournit une tension grâce à la rotation d'un conducteur dans un champ magnétique.
Photo-électricité Certaines substances sont photo-électriques, c'est-à-dire qu'elles peuvent émettre des électrons lorsque la lumière sollicite leur surface. L'élément césium sert souvent de source de photo-électrons.
Les piles photovoltaïques et les piles solaires utilisent du silicium pour également générer une tension de sortie sous l'action d'une lumière d'entrée. La variation de résistance de l'élément sélénium
sous l'action de la lumière en constitue un autre exemple. Cet effet, associé à l'utilisation d'une source de tension constante, permet de produire de larges variations entre le courant d'obscurité et le courant de luminosité. De telles caractéristiques sont la base de nombreux dispositifs photo-électriques comme les tubes analyseurs de télévision, les piles photo-électriques et les phototransistors.
Piézo-électricité
Une autre source de courant électrique joue un rôle important dans les microphones, les oscillateurs, les phonographes et les stabilisateurs de fréquence. On utilise des cristaux qui produisent de faibles f.é.m. lorsqu'on exerce une pression sur eux. C'est l'effet piézoélectrique.
Émission thermoionique
Sous l'action de la chaleur, certaines substances peuvent littéralement produire des électrons à leur surface par «ébullition». Cette émission d'électrons peut être contrôlée pour fournir des applications utiles du courant électrique. L'électrode d'émission est appelée la cathode, tandis que Y anode sert à recueillir les électrons émis.
La substance habituellement choisie pour ces cathodes thermoioniques chauffées au rouge est l'oxyde de baryum. Les tubes à vide des récepteurs de radio et de télévision fonctionnent selon ce principe.
Ces multiples et différentes façons de production d'électricité ne doivent pas nous faire oublier le fait que tous les électrons mis en jeu possèdent des charges et des masses identiques.
Que le flux électronique provienne d'une pile, d'une génératrice tournante ou d'un dispositif photo-électrique et qu'il soit commandé par un tube à vide ou un transistor, l'étude de la tension, du courant et de la résistance des différents types de circuits est régie par les principes de base exposés dans cet ouvrage.
Circuit fermé
Tout circuit électrique possède trois caractéristiques importantes (figure 1-20):
Figure 1-20 Schéma d'un circuit électrique fermé:
la source de la différence de potentiel est la pile, le chemin ininterrompu est constitué de la pile, du conducteur et de l'ampoule, l'ampoule présente une certaine résistance, (a) Photographie du circuit; (b) schéma de câblage; (c) schéma symbolique.
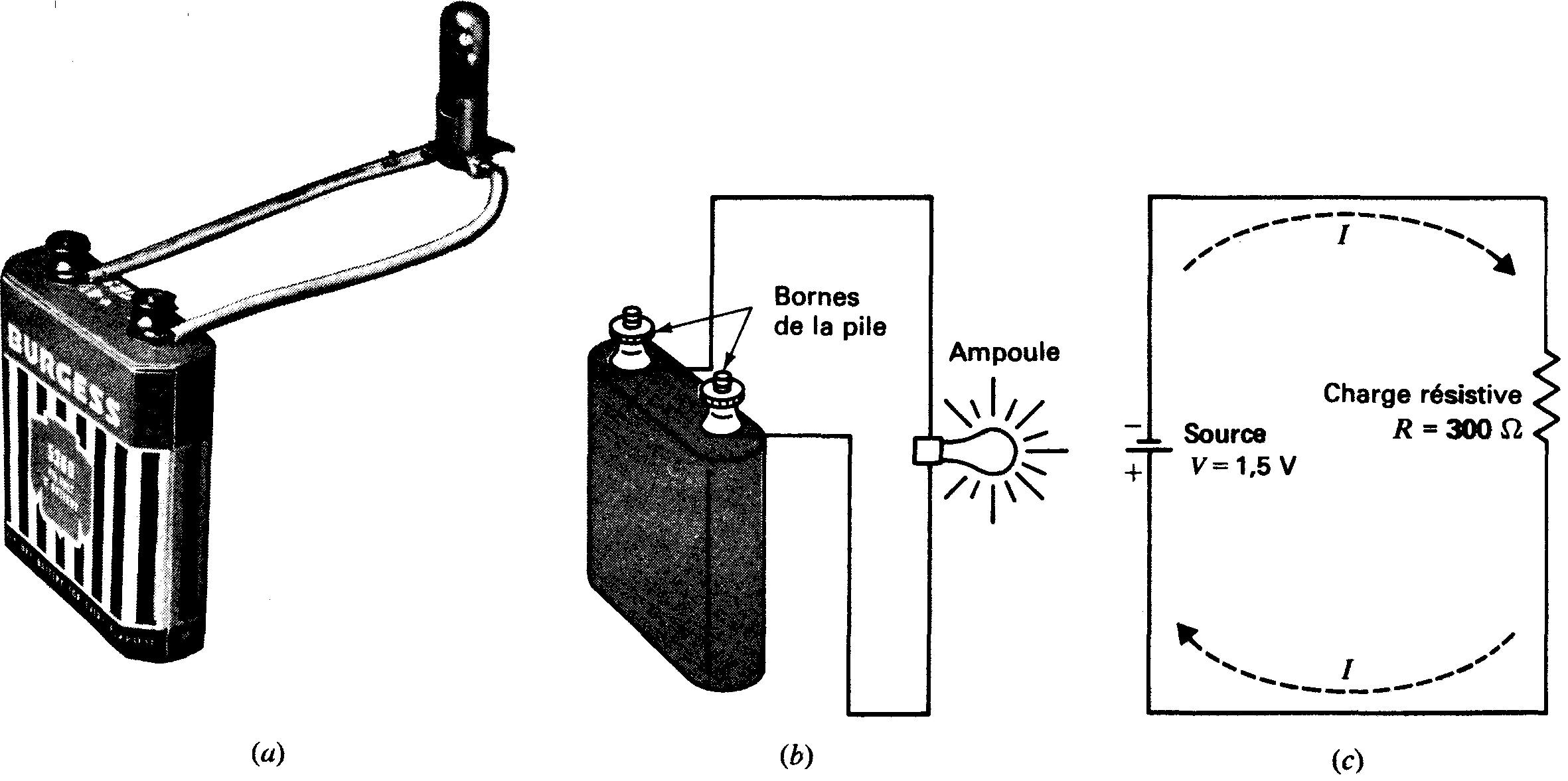
1. Il doit comporter au moins une source de différence de potentiel;
2. Il doit présenter un chemin ininterrompu au flux électronique à partir d'un côté de la source de tension appliquée à l'autre côté via le parcours extérieur;
3. Le parcours suivi par le courant présente normalement une résistance. Cette résistance a pour rôle soit de générer de la chaleur, soit de limiter l'intensité du courant.
Circuit ouvert
Un circuit présentant une coupure et donc une non-continuité de parcours pour le courant est dit ouvert. La résistance d'un circuit ouvert est infiniment grande. En conséquence, il ne circule aucun courant dans un circuit ouvert (figure 1-21).
Figure 1-21 Schéma d'un circuit électrique ouvert,
cette fois le conducteur est coupé et l'ampoule n'éclaire pas: la condition du chemin ininterrompu n'est pas respectée, (a) Photographie du circuit; (b) schéma de câblage; (c) schéma symbolique.
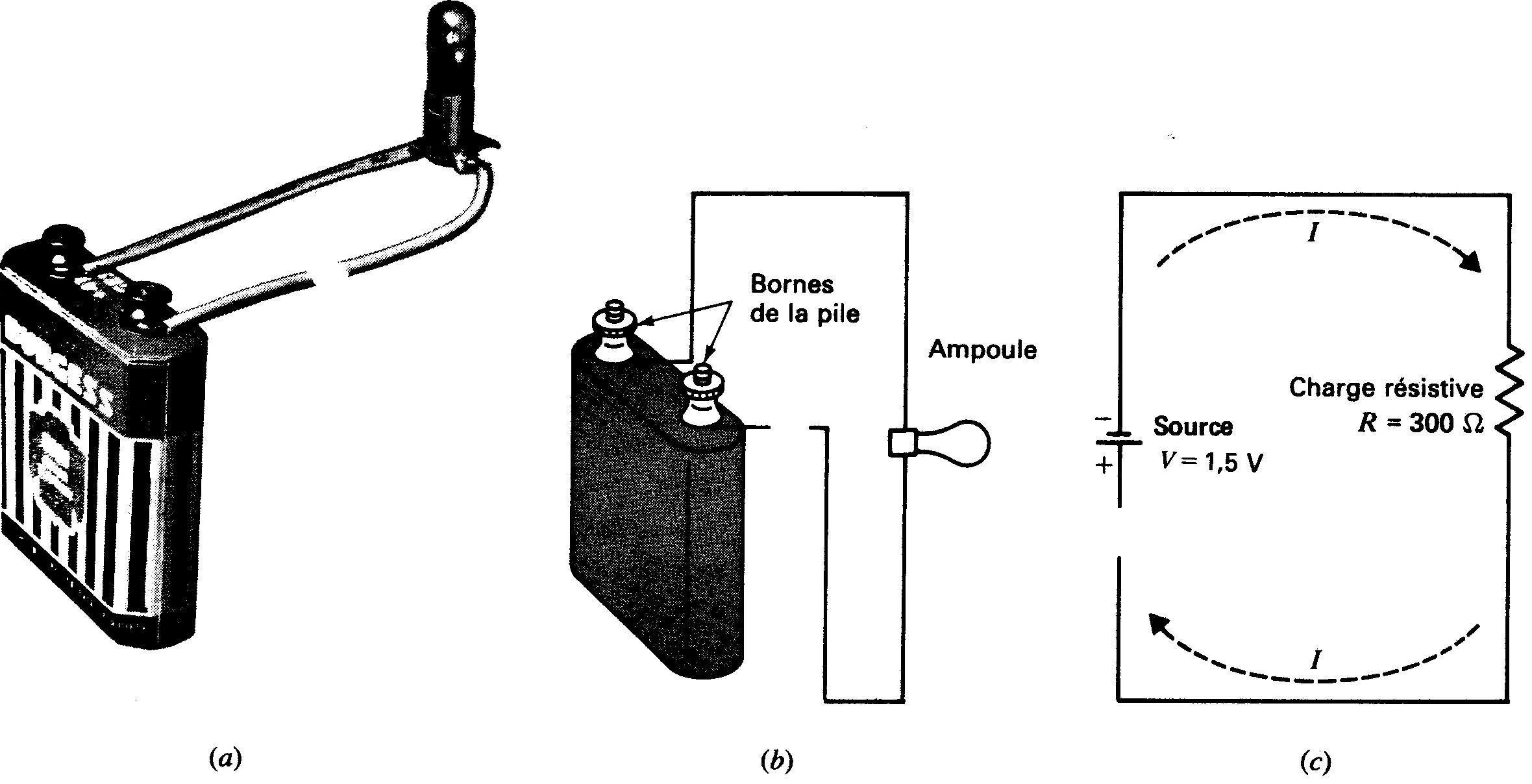
Court-circuit Dans un tel cas il existe un parcours fermé aux bornes de la source de tension, mais de résistance nulle. Il en résulte un courant élevé dans le court-circuit.
Sens conventionnel du courant
Le sens de déplacement des charges positives, opposé à celui du flux électronique, est appelé le sens conventionnel du courant. En ingénierie électrique, les circuits sont habituellement étudiés en considérant le sens conventionnel du courant.
Cela est dû au fait que selon les définitions de la force et du travail positifs, un potentiel positif est considéré supérieur à un potentiel négatif. Ainsi, le courant conventionnel est un déplacement de charges positives passant d'un potentiel positif à un potentiel négatif.
Le sens du courant conventionnel est donc le sens de déplacement des charges positives.
Problèmes pratiques 1.9 (réponses à la fin du chapitre) Répondre par vrai ou faux:
(a) Les électrons d'un isolant sont arrachés par friction;
(b) À toute charge en mouvement est associée un champ magnétique;
(c) Un court-circuit est identique à un circuit ouvert.
1.10 COURANT CONTINU (ce) ET COURANT ALTERNATIF (ca)
Le flux électronique illustré à la figure 1-20 (c) est un courant continu car il présente un seul sens de déplacement. Ce courant est unidirectionnel car la pile maintient la tension de sortie à la même polarité.
Un circuit continu est caractérisé par un flux de charges unidirectionnel et par la polarité fixe de la tension appliquée.
En réalité, le courant peut être un déplacement de charges positives plutôt que d'électrons, mais ce sens conventionnel ne change pas le fait que le courant continu présente un seul sens de circulation.
De plus, le courant circulera dans un seul sens et sera donc encore un courant continu même si la tension de sortie de la source varie, à la condition expresse que la polarité reste la même.
Figure 1-22 Comparaison des tensions continue et alternative:
(a) tension continue fixe d'une seule polarité fournie par une batterie;
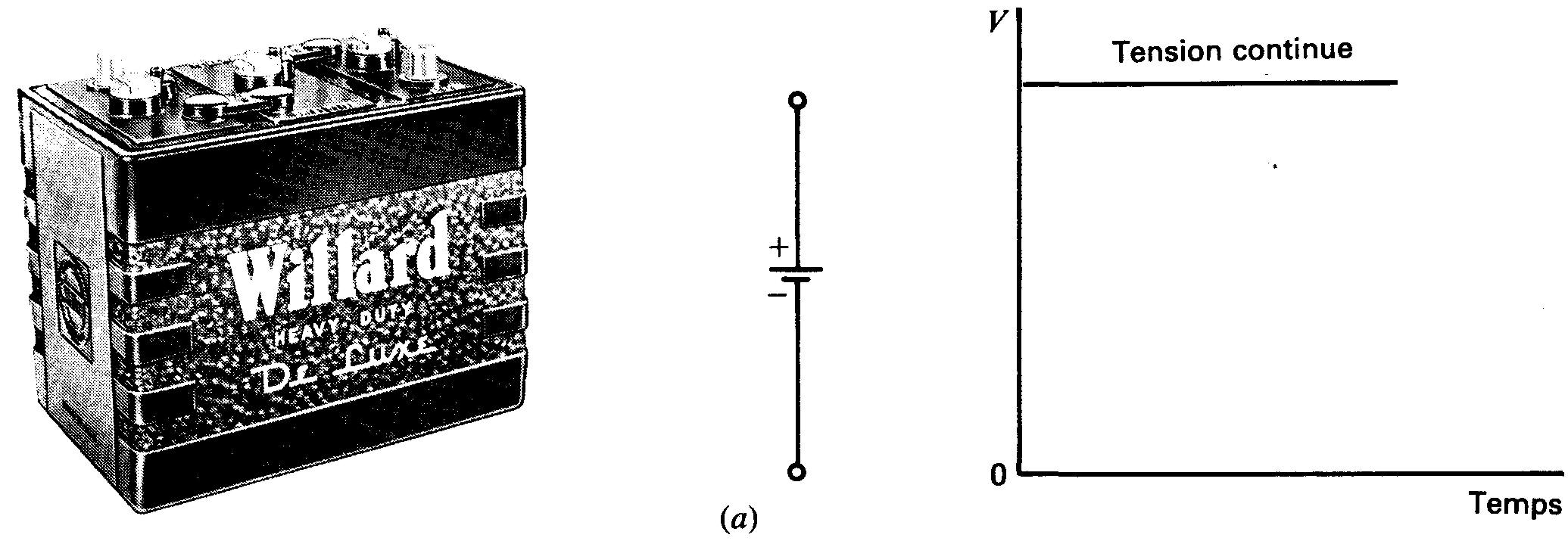
(b) tension alternative sinusoïdale à polarité alternée, fournie par une génératrice à courant alternatif tournante de laboratoire. Le tracé illustre un cycle complet. (Sargent Welch Scientific Co. )
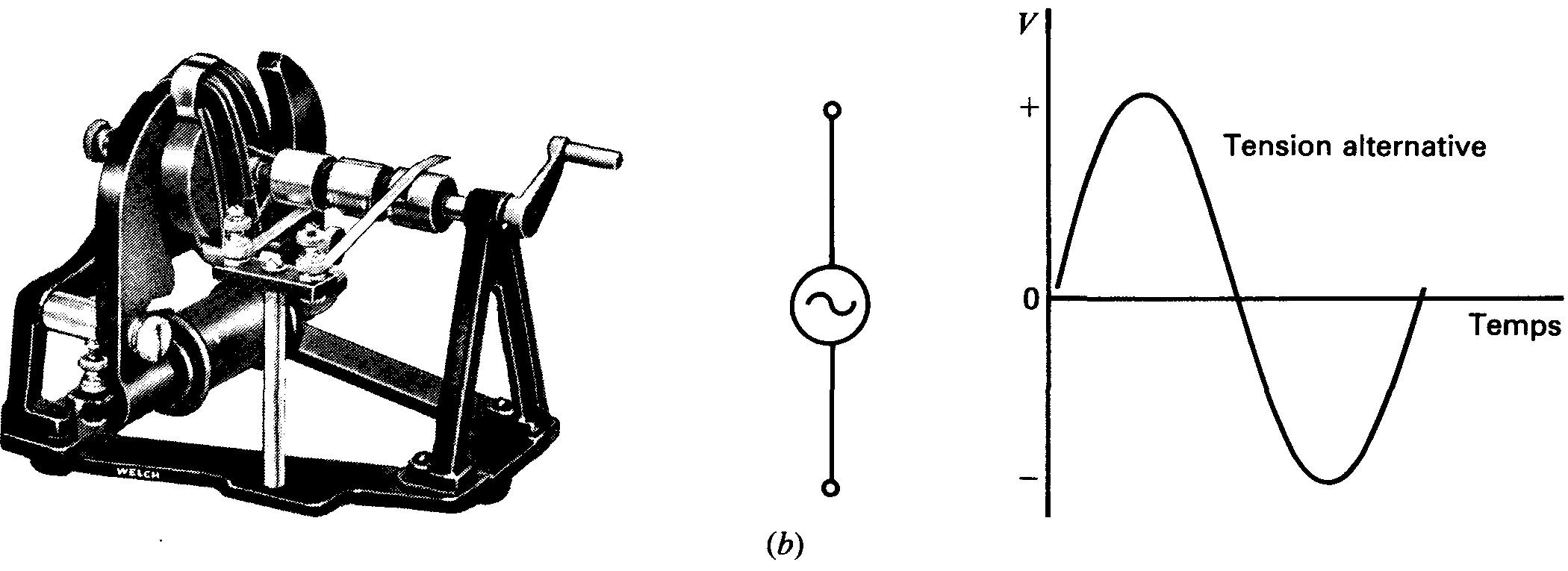
Une batterie est une source de tension continue fixe car sa polarité est fixe et sa tension de sortie est une valeur continue fixe (figure 1-22 (a) ). Elle est aussi une source de courant continu fixe.
Une source de tension alternative inverse ou alterne périodiquement sa polarité (figure 1-22 (b).
En conséquence, le courant alternatif pouvant être fourni inverse périodiquement son sens. Le flux électronique, donc le courant, quant à lui, circule toujours de la borne négative de la source de tension à sa borne positive via le circuit, non représenté à la figure 1-22 (b).
Mais lorsque le générateur change de polarité, le courant doit changer de sens de parcours.
Le secteur alternatif de fréquence 60 Hz utilisé dans la plupart des maisons en est un exemple. La fréquence signifie que la polarité de la tension et donc le sens de circulation du courant présentent 60 cycles d'inversion par seconde.
Cette unité de un cycle par seconde porte le nom de un hertz (Hz); on en déduit donc que 60 cycles par seconde est une fréquence de 60 Hz.
Le chapitre 16 et les suivants traitent en détail des circuits à courant alternatif.
On étudiera tout d'abord les circuits à courant continu car ils sont ordinairement plus simples. Les lois régissant les circuits à courant continu sont également valides pour les circuits à courant alternatif.
Ces deux types de courant sont importants car la plupart des circuits électroniques sont soumis à des tensions continues et à des tensions alternatives.
La figure 1-22 illustre ces deux types de tension.
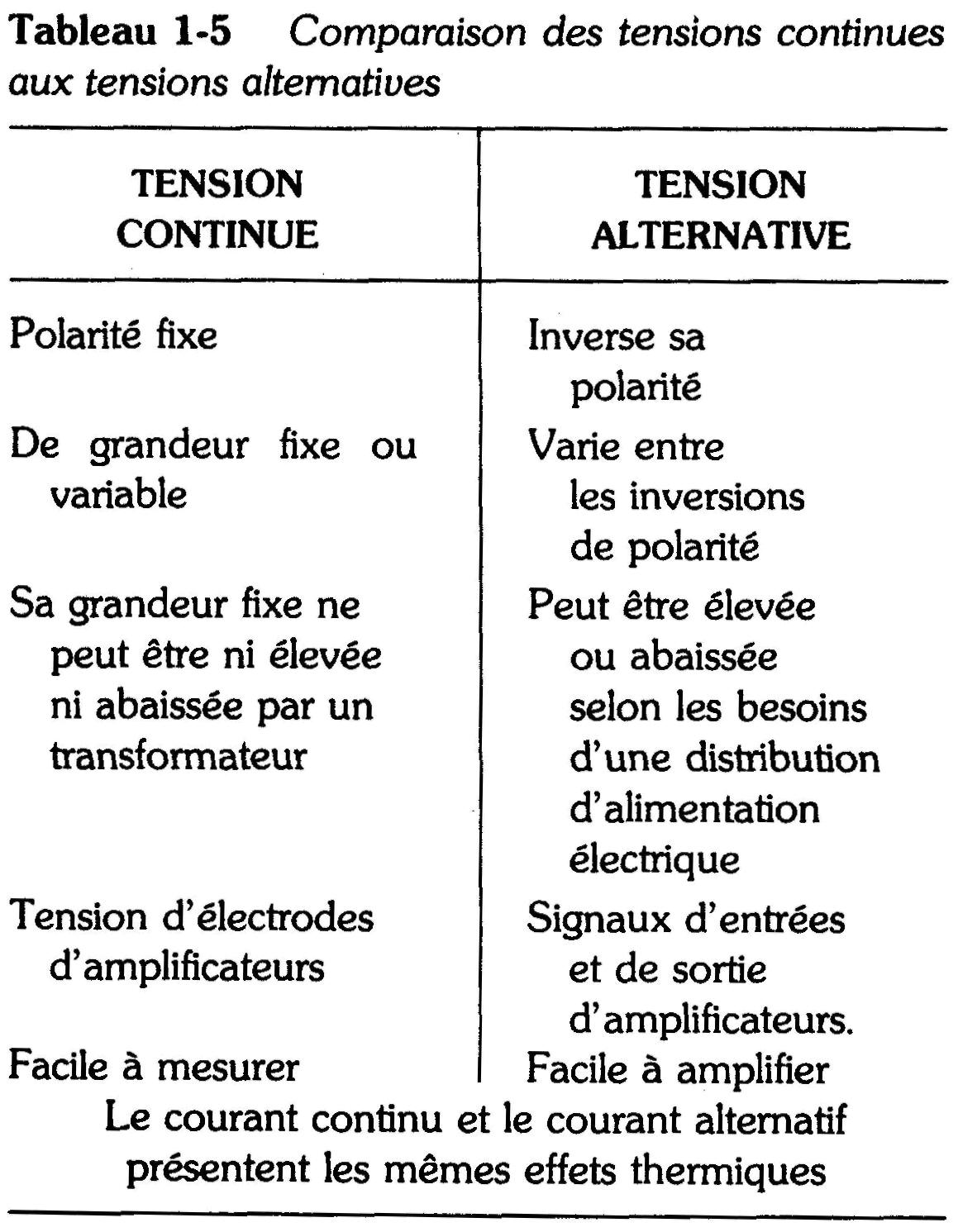
Le tableau 1-5 permet de comparer leurs applications.
Remarquer que les transistors et les tubes requièrent des tensions d'électrodes continues afin d'amplifier la tension alternative du signal.
Problèmes pratiques 1.10 (réponses à la fin du chapitre) Répondre par vrai ou faux:
(a) L'inversion de la polarité de la tension appliquée entraîne une inversion du sens de circulation du courant;
(b) Une batterie est une source de tension continue car elle ne peut inverser la polarité de ses bornes de sortie.
1.11 PUISSANCE ET RENDEMENT
La notion de puissance suggère l'idée de vitesse de consommation de l'énergie ou de sa transformation d'une forme en une autre.
L'énergie étant l'aptitude à l'accomplissement d'un certain travail, nous pouvons donc dire que la puissance est reliée à la rapidité d'exécution d'un travail. Nous associerons ces deux grandeurs dans notre définition de la puissance.
La puissance est le taux de consommation de l'énergie ou d'exécution d'un travail.
Son symbole est P.
Lorsque nous payons notre note d'électricité à la société distributrice, nous payons en fait l'énergie électrique consommée et non la puissance utilisée.
La société distributrice ne s'enquiert pas du rythme auquel cette énergie a été dépensée (la puissance) mais plutôt de la quantité d'énergie consommée.
Nous avons vu que l'unité de base de l'énergie est le joule et que celle du temps est la seconde. L'unité de base de la puissance sera donc le joule par seconde (J/s).
En l'honneur du scientifique et inventeur écossais James Watt, cette unité a reçu le nom de watt (symbole W). Un watt est donc égal à un joule par seconde.
La relation entre la puissance, l'énergie et le temps est:
Puissance (P) = énergie (W) / temps (t)
En réarrangeant ces termes on obtient:
W = P x t 1.6
Utilisons cette expression pour résoudre le problème d'électricité ci-dessous.
Comme il arrive pour d'autres symboles, les symboles de l'énergie ou du travail et de l'unité de puissance dénotent deux notions tout à fait distinctes. Il ne faut donc pas confondre W (énergie ou travail) avec W (watts).
Exemple 3
Calculer l'énergie requise par le fonctionnement d'une ampoule électrique de 60 W durant 30 min.
Réponse
W = P x t = 60 W (30 x 60 s), car il y a 60 s dans 1 min
= 108 000 watts-secondes
= 108 000 J
L'énergie requise est donc de 108 000 J.
Rendement
Le rendement s'exprime soit en fonction de l'énergie, soit en fonction de la puissance.
En fonction de l'énergie, le rendement d'un dispositif électrique ou autre est, en pour cent, le rapport η (lettre grecque êta): énergie utile de sortie sur énergie totale d'entrée multiplié par 100 %.
En fonction de la puissance, le rendement d'un dispositif électrique ou autre est, en pour cent, le rapport η:
puissance de sortie sur puissance d'entrée multiplié par 100 %, soit:
 1.7
1.7
Exemple 4
Calculer le rendement d'un récepteur de radio exigeant une puissance d'entrée de 4 W pour fournir une puissance de sortie de 0,5 W.
Réponse
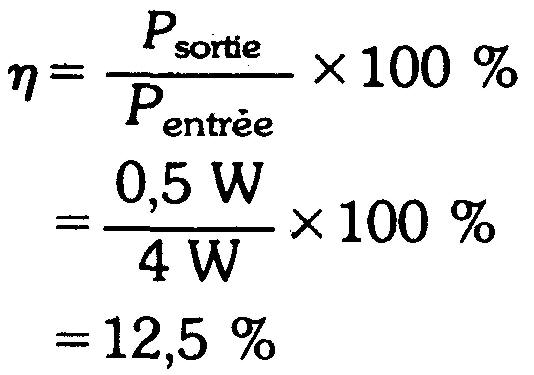
Problèmes pratiques 1.11 (réponses à la fin du chapitre)
(a) Quelle est l'unité de base de la puissance?
(b) Calculer le nombre d'unités de base d'énergie contenues dans un watt-seconde.
(c) Le rendement se calcule en fonction d'une grandeur parmi deux. Citer ces deux grandeurs.
Résumé
1. La matière et l'énergie sont intimement liées.
De manière classique, la masse est une constante mais, en réalité, selon Einstein, c'est le couple masse-énergie d'un système qui demeure constant. La matière existe sous trois états: solide, liquide et gazeux.
2. Toute substance est composée d'un ou de plusieurs éléments.
Un élément est un corps simple c'est-à-dire non décomposable. Une molécule est la plus petite partie d'une substance répondant encore à la définition de cette substance.
Sa composition est exprimée par sa formule dite moléculaire selon les lois des proportions définies et des proportions multiples. Toute substance est un élément, un composé, un mélange ou une solution.
3. L'électricité est présente dans toute substance sous forme d'électrons et de protons.
4. L'électron est la quantité fondamentale d'électricité négative, le proton est la quantité fondamentale d'électricité positive.
Ils présentent tous deux la même valeur de charges, mais de polarités opposées. La charge de 6,25 x 1018 électrons ou protons est l'unité pratique de charge de 1 coulomb.
5. Les charges de même polarité se repoussent; les charges de polarités opposées s'attirent.
Pour qu'il y ait force d'attraction ou de répulsion il faut avoir des charges de polarités différentes.
6. Les électrons se déplacent vers les protons car un électron a une masse égale à V2000 x la masse d'un proton.
Les électrons en mouvement constituent un courant d'électrons.
7. Le nombre atomique d'un élément donne le nombre de protons logés dans le noyau de son atome.
Ce nombre de protons est équilibré par un nombre égal d'électrons en orbite.
8. Le nombre d'électrons de la couche extérieure est appelé la valence de l'élément.
9. Le tableau 1-6 énumère les caractéristiques des circuits électriques.
Dans la colonne des symboles, les lettres minuscules q, v et i indiquent que la valeur de la grandeur correspondante varie en fonction du temps.
Les lettres minuscules r et g représentent des caractéristiques internes d'une source.


10. Les types de charges négatives comprennent les électrons et les ions négatifs.
Les types de charges positives comprennent les protons, les ions positifs et les charges des trous.
11. Un circuit électrique constitue pour le flux électronique un parcours fermé.
La différence de potentiel doit être branchée pour produire un courant aux bornes du circuit. Dans le parcours extérieur, en dehors de la source de tension, les électrons circulent de la borne négative vers la borne positive. Le sens conventionnel est le sens inverse.
12. Le courant continu circule dans un seul sens car la source de tension continue présente une polarité fixe. Le courant alternatif inverse périodiquement son sens car la source de tension alternative inverse sa polarité.
13. La puissance est la quantité d'énergie consommée par seconde, ou la quantité de travail effectué par seconde.
14. Le rendement caractérise l'efficacité d'un système.
Exercices de contrôle
(Voir Réponses aux exercices de contrôle)
Voici un moyen de contrôler si vous avez bien assimilé le contenu de ce chapitre. Ces exercices sont uniquement destinés à vous évaluer vous-même.
Répondre par vrai ou faux.
1. Toute substance présente de l'électricité sous forme d'électrons et de protons logés dans l'atome.
2. L'électron est la particule fondamentale de charge négative.
3. Un proton présente la même quantité de charge qu'un électron, mais sa polarité est opposée à celle de l'électron.
4. Les électrons se repoussent entre eux, mais ils sont attirés par les protons.
5. La force d'attraction ou de répulsion entre les charges s'exerce dans leur champ électrique.
6. Le noyau, de charge positive, est la partie fixe massive de l'atome.
7. Les neutrons augmentent la masse du noyau de l'atome et non sa charge électrique.
8. Un élément de numéro atomique 12 possède 12 électrons en orbite.
9. Cet élément présente une valence électronique égale à + 2.
10. Pour produire un courant dans un circuit, il faut connecter une différence de potentiel aux bornes d'un parcours fermé.
11. Une tension continue a une polarité fixe tandis qu'une tension alternative inverse périodiquement la sienne.
12. L'unité de mesure de la quantité de charge emmagasinée est le coulomb.
13. Le retrait de 3 C d'un diélectrique ou isolant présentant un excès de 2 C entraînera une charge positive dans ce diélectrique égale à 1 C.
14. Une charge de 5 C passant en un point donné chaque seconde constitue un courant de 5 A.
15. Un courant de charge d'un diélectrique égal à 7 A provoquera une accumulation de 14 C en deux secondes.
16. Une source de tension a deux bornes chargées différemment.
17. Un ion est un atome chargé.
18. La résistance de quelques mètres d'un fil de cuivre est pratiquement nulle.
19. La résistance d'un isolant en caoutchouc ou en plastique d'un conducteur est pratiquement nulle.
20. Une résistance de 600 H présente une conductance de 6 S.
Questions
1. Définir brièvement chacune des grandeurs suivantes et donner son unité et son symbole: charge, tension, courant, résistance et conductance.
2. Nommer deux bons conducteurs, deux bons isolants et deux semi-conducteurs.
3. Expliquer brièvement pourquoi il ne circule aucun courant dans une ampoule non connectée aux bornes d'une source de tension.
4. Dans un circuit quelconque:
a) énoncer deux conditions de production d'un courant;
b) indiquer le sens de déplacement du flux électronique.
5. Dessiner la structure atomique de l'élément sodium (Na) de numéro atomique 11. Dire quelle est sa valence.
6. Écrire votre nom relativement au courant continu et à la tension continue et remarquer comment il diffère de son écriture relativement à la tension et au courant alternatifs.
7. Écrire la formule mathématique de chacun des énoncés suivants:
a) le courant est le taux de variation de la charge en fonction du temps;
b) la charge est le courant accumulé durant un temps donné.
8. Dire pourquoi les protons ne constituent pas, pour le courant, une source de charges en mouvement.
9. Donner deux méthodes de production de charges électriques et indiquer leurs applications pratiques.
10. Qu'entend-on par puissance?
11. Définir le rendement.
Problèmes
(Les réponses aux problèmes de numéro impair sont données à Réponses aux problèmes de numéro impair )
1. Soit une charge de 8 C passant par un point donné toutes les deux secondes.
Calculer la valeur du courant en ampères.
2. Un courant de 4 A charge un isolant durant 2 s.
Calculer la charge accumulée.
3. Convertir les résistances suivantes en conductances exprimées en Siemens:
a) 1000 Ω; b) 500 Ω; c) 10 Ω; d) 0,1 Ω.
4. Convertir les conductances suivantes en résistances exprimées en ohms:
a) 0,001 S; b) 0,002 S; c) 0,1 S; d) 10 S.
5. Une batterie fournit une énergie de 11 J destinée à déplacer une charge de 5 C.
Calculer la tension de la batterie. (Rappel: un volt égale un joule par coulomb.)
6. Une substance présentant une pénurie de 25 x 1018 électrons obtient 31,25 x 1018 électrons.
Le surplus d'électrons passe par un point donné en 1 s.
Calculer le courant produit par le flux électronique résultant.
7. Convertir une conductance de 5 S en une résistance.
8. Soit un système de puissance d'entrée égale à 12 W et de puissance de sortie égale à 10 W.
Calculer son rendement.
Réponses aux problèmes pratiques
