|
Nombre Atomique |
14 |
Conductibilité thermique |
148 W m-1 K-1 |
|
Groupe |
14 |
Rayon atomique |
117,6 pm |
|
Période |
3 |
Configuration électronique |
[Ne] 3s2 3p2 |
|
Année de découverte |
1824 |
Électronégativité |
1,9 |
|
Masse Atomique |
28,0855 |
Résistivité électrique (20 °C) |
10 μΩcm |
|
Nombre d’oxydation |
-4 +2 +4 |
État physique (20 °C) |
Solide gris noir à reflet bleuté |
|
Densité (g dm-3) |
2329 (293 K)
|
Volume molaire (cm3 mol-1) |
12,06 (293 K)
|
|
À l’état Naturel |
|
Molécule courante |
SiO2 |
Propriétés thermiques |
|||
|
Point de fusion |
1414 °C |
Enthalpie de fusion |
39,6 kJ mol-1 |
|
Point d'ébullition |
3265 °C |
Enthalpie d'évaporation |
383,3 kJ mol-1 |
|
Température critique |
4886 °C |
Chaleur d'atomisation |
451,29 kJ mol-1 |
Énergie d' ionisation et abondance |
|||
|
Énergie de 1er ionisation |
786,52 kJ mol-1 |
Abondance (air) |
- |
|
Énergie de 2ème ionisation |
1577,15 kJ mol-1 |
Abondance (croûte terrestre) |
267700 ppm |
|
Énergie de 3ème ionisation |
3231,61 kJ mol-1 |
Abondance (océans) |
3 ppm |
|
Potentiel(s) d'ionisation |
8,15; 16,35; 33,49 eV |
|
|
|
Propriétés nucléaires |
|||
|
Isotope |
Masse atomique |
Abondance (%) |
Masse volumique à 20 °C |
|
28Si 29Si 30Si |
27,976926533 28,97649472 29,97377022 |
92,23 4,67 3,10 |
2,32 g/cm3 |
|
|
|
|
|
|
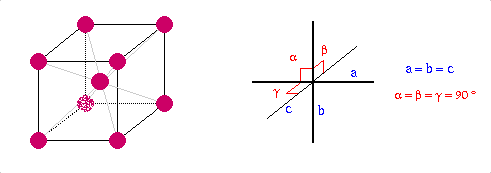
Structure cristalline |
Cubique à faces centrées |
|
a=543.07
Fd3m |