|
Nombre Atomique |
16 |
Conductibilité thermique |
0,269 W m-1 K-1 |
|
Groupe |
16 |
Rayon atomique |
103,5 pm |
|
Période |
3 |
Configuration électronique |
[Ne] 3s2 3p4 |
|
Année de découverte |
Antiquité |
Électronégativité |
2,58 |
|
Masse Atomique |
32,065 |
Résistivité électrique (20 °C) |
2E+23 μΩcm |
|
Nombre d’oxydation |
-2 +4 +6 |
État physique (20 °C) |
Solide jaune citron |
|
Densité (g dm-3) |
2070 (alpha,
293 K) |
Volume molaire (cm3 mol-1) |
15,49 (alpha,
293 K) |
|
À l’état Naturel |
S8 |
Molécule courante |
H2SO4 |
Propriétés thermiques |
|||
|
Point de fusion |
115,21 °C |
Enthalpie de fusion |
1,7175 kJ mol-1 |
|
Point d'ébullition |
444,60 °C |
Enthalpie d'évaporation |
9,62 kJ mol-1 |
|
Température critique |
1041 °C |
Chaleur d'atomisation |
276,6 kJ mol-1 |
Énergie d' ionisation et abondance |
|||
|
Énergie de 1er ionisation |
999,60 kJ mol-1 |
Abondance (air) |
1 ppm |
|
Énergie de 2ème ionisation |
2251,78 kJ mol-1 |
Abondance (croûte terrestre) |
260 ppm |
|
Énergie de 3ème ionisation |
3356,75 kJ mol-1 |
Abondance (océans) |
900 ppm |
|
Potentiel(s) d'ionisation |
10,36; 23,24; 34,79 eV |
|
|
|
Propriétés nucléaires |
|||
|
Isotope |
Masse atomique |
Abondance (%) |
Masse volumique à 20 °C |
|
32S 33S 34S 36S |
31,9720707 32,9714585 33,9678668 35,9670809 |
95,02 0,75 4,21 0,02 |
2,07 g/cm3 |
|
|
|
|
|
|
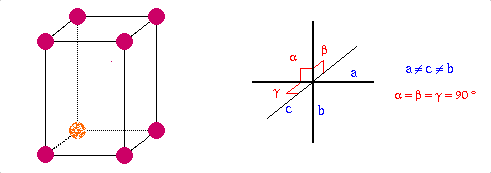
Structure cristalline |
Orthorhombique à toute face centrée |
|
a=1046.46, b=1286.60, c=2448.60
Fddd |